题目内容
17. 利用原电池原理除去废水中的乙酸钠和对氯酚(
利用原电池原理除去废水中的乙酸钠和对氯酚( ),其原理如图所示,下列说法不正确的是( )
),其原理如图所示,下列说法不正确的是( )| A. | 电流方向从A极沿导线流向B极 | |
| B. | 每转移2mole-,有0.25mol CH3COO-被氧化 | |
| C. | 当外电路中有2mole-转移时,进入A极区的H+的个数为2NA | |
| D. | A极的电极反应式为 +H++e-═Cl-+ +H++e-═Cl-+ |
分析 原电池中阳离子移向正极,根据原电池中氢离子的移动方向可知A为正极,正极有氢离子参与反应,电极反应式为 +2e-+H+═
+2e-+H+═ +Cl-,电流从正极经导线流向负极,以此解答该题.
+Cl-,电流从正极经导线流向负极,以此解答该题.
解答 解:原电池中阳离子移向正极,根据原电池中氢离子的移动方向可知A为正极,正极有氢离子参与反应,电极反应式为 +2e-+H+═
+2e-+H+═ +Cl-,电流从正极经导线流向负极.
+Cl-,电流从正极经导线流向负极.
A.电流从正极A沿导线流向负极B,故A正确;
B.负极BCH3COO--8e-+4H2O=2HCO3-+9H+,每转移2mole-,有0.25mol CH3COO-被氧化,故B正确;
C.据电荷守恒,当外电路中有2mole-转移时,A极区增加的H+的数目为NA,故C错误;
D.A为正极,正极有氢离子参与反应,电极反应式为 +2e-+H+═
+2e-+H+═ +Cl-,故D错误;
+Cl-,故D错误;
故选CD.
点评 本题涉及原电池的工作原理以及应用的考查,为高频考点,侧重于学生的分析能力的考查,注意知识的迁移和应用是解题的关键,题目难度中等.

练习册系列答案
相关题目
7.常温下,下列各组离子一定能在指定溶液中大量共存的是( )
| A. | 投入足量漂白粉后的溶液中:Fe2+、H+、Cl-、SO42- | |
| B. | 0.1mol/LFeCl3溶液中:Na+、Ba2+、NO3-、SCN- | |
| C. | $\frac{{K}_{w}}{c({H}^{+})}$=1×10-13mol/L的溶液中:NH4+、Ca2+、Cl、NO3- | |
| D. | 水电离的c(OH-)=1×10-13mol/L的溶液中:K+、Na+、AlO2-、CO32- |
5.用18O标记的CH3CH218OH与乙酸反应制取乙酸乙酯,下列说法正确的是( )
| A. | 18O 存在于水中 | |
| B. | 18O 存在于乙酸乙酯和乙醇中 | |
| C. | 18O 存在于乙酸乙酯和水中 | |
| D. | 生成的乙酸乙酯的相对分子质量为88 |
12.暴露在空气中质量会变轻的物质是( )
| A. | 氢氧化钠 | B. | 食盐 | C. | 浓硫酸 | D. | 浓盐酸 |
2.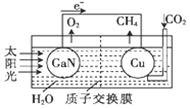 科学家用氮化镓材料与铜组装成如图所示的人工光合系统,利用该装置成功地实现了以CO2和H2O合成CH4.下列关于该电池叙述错误的是( )
科学家用氮化镓材料与铜组装成如图所示的人工光合系统,利用该装置成功地实现了以CO2和H2O合成CH4.下列关于该电池叙述错误的是( )
 科学家用氮化镓材料与铜组装成如图所示的人工光合系统,利用该装置成功地实现了以CO2和H2O合成CH4.下列关于该电池叙述错误的是( )
科学家用氮化镓材料与铜组装成如图所示的人工光合系统,利用该装置成功地实现了以CO2和H2O合成CH4.下列关于该电池叙述错误的是( )| A. | 电池工作时,是将太阳能转化为电能 | |
| B. | 铜电极为正极,电极反应式为:CO2+8e-+8H+═CH4+2H2O | |
| C. | 电池内部H+透过质子交换膜从左向右移动 | |
| D. | 为提高该人工光合系统的工作效率,可向装置中加入少量硝酸溶液 |
9.如图是研究铁被海水腐蚀的实验装置.图2中M是某种与铁片紧贴的金属,下列说法正确的是( )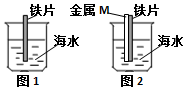

| A. | 图1铁片靠近烧杯底部的部分,腐蚀更严重 | |
| B. | 若M是锌片,可保护铁 | |
| C. | 若M是铜片,可保护铁 | |
| D. | M是铜或是锌都不能保护铁,是因没有构成原电池 |
6.0.1moL/L醋酸用蒸馏水稀释的过程中,下列说法正确的是( )
| A. | 电离程度增大,H+浓度增大 | B. | 电离程度减小,H+浓度减小 | ||
| C. | 电离程度增大,H+浓度减小 | D. | 电离程度减小,H+浓度增大 |