题目内容
14.短周期元素X、Y、Z、W的原子半径依次增大,其简单氢化物中X、Y、Z、W的化合价如表所示:| 元素 | X | Y | Z | W |
| 化合价 | -1 | -2 | -2 | -3 |
| A. | 最高价氧化物对应水化物的酸性:W>Z | |
| B. | 元素的非金属性:X>Y | |
| C. | 氢化物的沸点:Z>Y | |
| D. | 元素Y不存在同素异形现象 |
分析 Y、Z的最低化合价都为-2价,且原子半径Z>Y,可知Y为O元素,Z为S元素,X为-1价,且原子半径小于Y,应为F元素,W为-3价,且原子半径大于Z,应为P元素,结合元素周期率的递变规律解答该题.
解答 解:由以上分析可知X为F、Y为O、Z为S、W为P元素.
A.非金属性S>P,元素的非金属性越强,对应的最高价氧化物对应水化物的酸性越强,故A错误;
B.同周期元素从左到右元素的非金属性逐渐增强,非金属性F>O,故B正确;
C.O的电负性较强,对应的氢化物分子间存在氢键,沸点较高,故C错误;
D.O的同素异形体有氧气、臭氧等,故D错误.
故选B.
点评 本题考查结构性质位置关系应用,为高频考点,侧重考查学生的分析能力,根据化合价与原子半径推断元素是解题关键,注意对元素周期律的理解掌握,难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
4.下列实验操作、现象所对应的相关结论正确的是( )
| 实验 | 现象 | 结论 | |
| A | 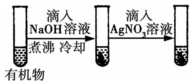 | 最后试管中出现白色沉淀 | 有机物中含 有氯原子 |
| B | 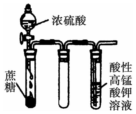 | 酸性高锰酸钾溶液褪色 | 浓硫酸有 吸水性 |
| C | 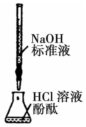 | 最后一滴标准液使酚酞由无色变为浅红色,且30s内不褪色 | 滴定达到 终点 |
| D | 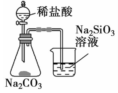 | Na2SiO3溶液变浑浊 | 非金属性 Cl>C>Si |
| A. | A | B. | B | C. | C | D. | D |
5.用18O标记的CH3CH218OH与乙酸反应制取乙酸乙酯,下列说法正确的是( )
| A. | 18O 存在于水中 | |
| B. | 18O 存在于乙酸乙酯和乙醇中 | |
| C. | 18O 存在于乙酸乙酯和水中 | |
| D. | 生成的乙酸乙酯的相对分子质量为88 |
2.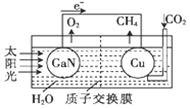 科学家用氮化镓材料与铜组装成如图所示的人工光合系统,利用该装置成功地实现了以CO2和H2O合成CH4.下列关于该电池叙述错误的是( )
科学家用氮化镓材料与铜组装成如图所示的人工光合系统,利用该装置成功地实现了以CO2和H2O合成CH4.下列关于该电池叙述错误的是( )
 科学家用氮化镓材料与铜组装成如图所示的人工光合系统,利用该装置成功地实现了以CO2和H2O合成CH4.下列关于该电池叙述错误的是( )
科学家用氮化镓材料与铜组装成如图所示的人工光合系统,利用该装置成功地实现了以CO2和H2O合成CH4.下列关于该电池叙述错误的是( )| A. | 电池工作时,是将太阳能转化为电能 | |
| B. | 铜电极为正极,电极反应式为:CO2+8e-+8H+═CH4+2H2O | |
| C. | 电池内部H+透过质子交换膜从左向右移动 | |
| D. | 为提高该人工光合系统的工作效率,可向装置中加入少量硝酸溶液 |
9.如图是研究铁被海水腐蚀的实验装置.图2中M是某种与铁片紧贴的金属,下列说法正确的是( )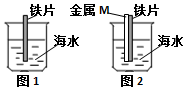

| A. | 图1铁片靠近烧杯底部的部分,腐蚀更严重 | |
| B. | 若M是锌片,可保护铁 | |
| C. | 若M是铜片,可保护铁 | |
| D. | M是铜或是锌都不能保护铁,是因没有构成原电池 |
19.原子序数依次增大的X、Y、Z、W四种短周期元素,X、W原子的最外层电子数与其电子层数相等,X分别与Y、Z形成10电子的化合物P和Q.P能使湿润的红色石蕊试纸变蓝,Q常温下是一种液体.下列说法正确的是( )
| A. | 简单离子半径大小关系为W>Z | |
| B. | P形成的水溶液能导电,说明P属于电解质 | |
| C. | 电解W的氯化物水溶液可以得到W单质 | |
| D. | 由X、Y、Z组成的盐的水溶液呈酸性,则溶液中该盐阳离子浓度小于酸根离子浓度 |
6.0.1moL/L醋酸用蒸馏水稀释的过程中,下列说法正确的是( )
| A. | 电离程度增大,H+浓度增大 | B. | 电离程度减小,H+浓度减小 | ||
| C. | 电离程度增大,H+浓度减小 | D. | 电离程度减小,H+浓度增大 |
4.甲、乙两个烧瓶收集等量的NO2气体并密封,又知2NO2?N2O4△H<0,将甲置于热水中,乙置于冷水中.下列有关现象描述中正确的是( )
| A. | 甲颜色加深 | B. | 乙颜色加深 | C. | 甲、乙颜色都加深 | D. | 甲、乙颜色都变浅 |
 .
. .
. .
.