题目内容
5.图表示常见元素单质及化合物相应转化关系,部分反应的产物没有全部列出.
已知:反应①是氯碱工业的基础反应,反应②常用来焊接铁轨,X、Y是生活中应用最为广泛的金属,气体氧化物Z是我国酸雨形成的罪魁祸首.
请回答下列问题:
(1)Z的化学式:SO2;
(2)反应②的化学反应方程式:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3;
(3)E溶液显酸性的原因是Fe3++3H2O?Fe(OH)3+3H+(用离子方程式表示);
(4)B与H溶液反应,则氧化剂与还原剂之比为:1:1.
分析 反应①是氯碱工业的基础反应,应是电解饱和食盐水得到氢氧化钠、氢气、氯气,D为NaOH溶液,X、Y是生活中应用最为广泛的金属,X能与B反应,则B为Cl2,C为H2,反应②常用来焊接铁轨,应为铝热反应,则X为Fe,G为Al2O3,可知Y为Al,E为FeCl3,F为Fe2O3,I为NaAlO2,气体氧化物Z是我国酸雨形成的罪魁祸首,应为SO2,则H为NaHSO3.
解答 解:反应①是氯碱工业的基础反应,应是电解饱和食盐水得到氢氧化钠、氢气、氯气,D为NaOH溶液,X、Y是生活中应用最为广泛的金属,X能与B反应,则B为Cl2,C为H2,反应②常用来焊接铁轨,应为铝热反应,则X为Fe,G为Al2O3,可知Y为Al,E为FeCl3,F为Fe2O3,I为NaAlO2,气体氧化物Z是我国酸雨形成的罪魁祸首,应为SO2,则H为NaHSO3.
(1)由以上分析可知Z为SO2,故答案为:SO2;
(2)反应②为铝热反应,反应方程式为:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3,故答案为:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3;
(3)E为FeCl3,为强酸弱碱盐,铁离子水解:Fe3++3H2O?Fe(OH)3+3H+,破坏水的电离平衡,溶液呈酸性,故答案为:Fe3++3H2O?Fe(OH)3+3H+;
(4)B与H溶液反应的方程式为:SO2+Cl2+2H2O=2HCl+H2SO4,反应中氯气为氧化剂,二氧化硫为还原剂,氧化剂和还原剂物质的量之比为1:1,故答案为:1:1.
点评 本题考查无机物推断,侧重于学生的分析能力的考查,熟练掌握元素化合物知识,熟记中学常见化学工业,难度中等.

| A. | 某无色溶液中:Al3+、Cu2+、SO${\;}_{4}^{2-}$、Cl- | |
| B. | 由水离子的c(H+)=1×10-12mol•L-1的溶液中:Ba2+、K+、Cl-、NO${\;}_{3}^{-}$ | |
| C. | c(OH-)/c(H+)═1012的溶液中:Na+、Mg2+、NO${\;}_{3}^{-}$、Cl- | |
| D. | 含有大量HCO${\;}_{3}^{-}$的溶液中:NH${\;}_{4}^{+}$、Al3+、Ca2+、Cl- |
| A. | 标准状况下,22.4 L 苯中含有的苯分子数是NA | |
| B. | 标准状况下,1mol氦气中含有的核外电子数为4NA | |
| C. | 常温常压下,15g乙烷分子中含有的碳氢键数目为3 NA | |
| D. | 常温常压下,0.10 mol•L-1CH3COOH溶液中含有的H+数小于0.1NA |
| A. | H2O | B. | SO3 | C. | NaH | D. | NH3 |
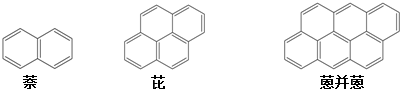
| A. | C50H30 | B. | C154H56 | C. | C154H60 | D. | C150H56 |
| A. | 钠与水反应:Na+2H2O═Na++2OH-+H2↑ | |
| B. | 碳酸钠溶液中加入足量盐酸:CO32-+2H+═CO2↑+H2O | |
| C. | 铁与稀盐酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| D. | 氯化铝溶液中加入过量的氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O |
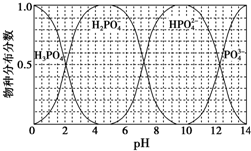 磷的重要化合物NaH2PO4、Na2HPO4和Na3PO4可通过H3PO4与NaOH溶液反应获得,含磷各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系如图所示.
磷的重要化合物NaH2PO4、Na2HPO4和Na3PO4可通过H3PO4与NaOH溶液反应获得,含磷各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系如图所示.