题目内容
9.已知:①C(s)+O2(g)═CO2(g);△H=-393.5kJ•mol-1②2CO(g)+O2(g)═2CO2(g);△H=-566kJ•mol-1
③TiO2(s)+2Cl2(g)═TiCl4(s)+O2(g);△H=+141kJ•mol-1
则TiO2(s)+2Cl2(g)+2C(s)═TiCl4(s)+2CO(g)的△H=-80kJ•mol-1.
在101kPa时,H2在1.00mol O2中完全燃烧生成2.00mol H2O(l)放出571.6kJ的热量.
(1)H2的标准燃烧热为285.8KJ/mol,表示H2标准燃烧热的热化学方程式为H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8KJ/mol.
(2)若1g水蒸气转化为液态水放热2.444kJ,则4g氢气完全燃烧生成气态水时,放出的热量为483.6KJ.
分析 利用盖斯定律,将①×2+③-②即得到反应TiO2(s)+2Cl2(g)+2C(s)═TiCl4(s)+2CO(g)的△H,反应热为△H=2△H1+△H3-△H2,以此解答该题;
(1)燃烧热指1mol可燃物完全燃烧生成稳定的化合物时所放出的热量;
(2)1g水蒸气转化成液态水放热2.444kJ,故18g水蒸气转化成液态水放出热量2.444kJ×18=44kJ,故反应H2O(g)=H2O(l)的反应热△H=-44kJ/mol,由此分析解答.
解答 解:利用盖斯定律,将①×2+③-②即得到反应TiO2(s)+2Cl2(g)+2C(s)═TiCl4(s)+2CO(g)的△H,反应热为△H=2△H1+△H3-△H2=2×(-393.5kJ•mol-1)+(+141kJ•mol-1)-(-566kJ•mol-1)=-80kJ•mol-1,故答案为:-80kJ•mol-1;
(1)在101kPa时,H2在1.00molO2中完全燃烧生成2.00mol液态H2O,放出571.6kJ的热量,即2mol氢气完全燃烧放出571.6kJ的热量,则1mol氢气完全燃烧放出的燃量为285.8KJ,所以氢气的燃烧热为-285.8KJ/mol,氢气和氧气都是气态,水是液态,则氢气的燃烧热的热化学方程式为:H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8KJ/mol;
故答案为:285.8KJ/mol;H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8KJ/mol;
(2)1g水蒸气转化成液态水放热2.444kJ,故18g水蒸气转化成液态水放出热量2.444kJ×18=44kJ,故反应H2O(g)=H2O(l)的反应热△H=-44kJ/mol,所以H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H=-285.8KJ/mol+44KJ/mol=-241.8KJ/mol,则4g氢气完全燃烧生成气态水时,放出的热量为2×241.8KJ=483.6KJ,故答案为:483.6KJ.
点评 本题考查热化学方程式的书写与反应热的计算,难度不大,注意掌握热化学方程式的书写,物质聚集状态的分析判断,盖斯定律的计算应用,题目较简单.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 苯酚钠 | B. | 酯酸钠 | C. | 氢氧化钠 | D. | 石灰水 |
| A. | 2.4gMg和6.5g Zn | B. | Mg和Zn各2.5g | C. | Mg和Al各2.5g | D. | 2.3gNa和2.4gMg |
| A. |  乙醇 | B. |  金属钠 | C. |  天然气 | D. |  乙酸 |
| A. | 常温常压下CH4是液体 | B. | 一氯甲烷分子式为CH4Cl | ||
| C. | CH4与Cl2可以发生加成反应 | D. | CH4完全燃烧生成CO2和H2O |
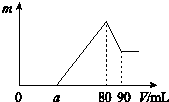 把一定质量的镁、铝混合物投入到2mol•L-1的盐酸中,待金属完全溶解后,向溶液中加入2mol•L-1的氢氧化钠溶液,生成沉淀的质量与加入氢氧化钠溶液的体积关系如图所示.
把一定质量的镁、铝混合物投入到2mol•L-1的盐酸中,待金属完全溶解后,向溶液中加入2mol•L-1的氢氧化钠溶液,生成沉淀的质量与加入氢氧化钠溶液的体积关系如图所示.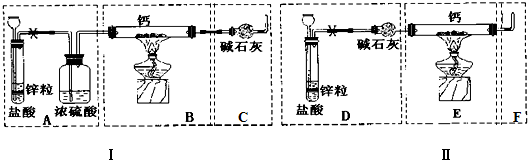
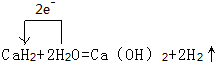 ,结合上述反应,实验结束后,甲同学取少量产物,小心加入水中,观察到有气泡冒出,溶液中加入酚酞后显红色,该同学据此推断,上述实验确有CaH2生成.请你分析该同学的判断是否合理?(填“是”或“否”).若不合理解释原因(若判断合理,此问不用两答)否,金属钙和水反应也有相似的实验现象
,结合上述反应,实验结束后,甲同学取少量产物,小心加入水中,观察到有气泡冒出,溶液中加入酚酞后显红色,该同学据此推断,上述实验确有CaH2生成.请你分析该同学的判断是否合理?(填“是”或“否”).若不合理解释原因(若判断合理,此问不用两答)否,金属钙和水反应也有相似的实验现象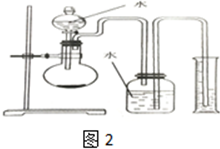
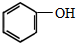 (制酚醛树脂)
(制酚醛树脂) 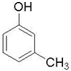 (生产杀虫剂)⑤CH2=CH─CH=CH2(合成橡胶原料) ⑥HCHO( 防腐剂 )
(生产杀虫剂)⑤CH2=CH─CH=CH2(合成橡胶原料) ⑥HCHO( 防腐剂 )