题目内容
4.托盘天平两盘各放置一个盛有100g 9.8%的稀硫酸的烧杯,并使天平保持平衡.若两烧杯中分别加入下列各组物质,反应结束后,天平仍保持平衡的是( )| A. | 2.4gMg和6.5g Zn | B. | Mg和Zn各2.5g | C. | Mg和Al各2.5g | D. | 2.3gNa和2.4gMg |
分析 如果酸过量金属完全反应,则相同质量的不同金属与同质量的酸反应后生成气体的质量肯定不同,天平不能保持平衡;如果金属过量酸完全反应,产生H2的质量必相同,此时天平必保持平衡,可以据此求算出生成等质量的氢气所消耗的金属的质量,然后进行判断即可.
解答 解:由题意可以知道只有在硫酸量不足的条件下才可能使天平依然平衡,其中硫酸的质量为:100g×9.8%=9.8g;
铁、锌、镁和铝与硫酸反应的化学方程式为:2Na+H2SO4═Na2SO4+H2↑,Zn+H2SO4═ZnSO4+H2↑,Mg+H2SO4═MgSO4+H2↑,2Al+3H2SO4═Al2(SO4)3+3H2↑为了便于比较我们将该反应中的氢气的化学计量数化为1,即为:
$\frac{2}{3}$Al+H2SO4═$\frac{1}{3}$Al2(SO4)3+H2↑
2Na-Zn-Mg-$\frac{2}{3}$Al-H2SO4 -H2↑
46 65 24 18 98 2
4.6g 6.5g 2.4g 1.8g 9.8g 0.2g
A、根据上述解答可以知道2.4gMg和6.5g Zn,生成等质量的氢气,所以反应完毕,天平不再平衡,故A错误;
B、根据上述解答可以知道Mg和Zn各2.5g中,即生成氢气的质量不等,所以反应完毕,天平不再平衡,故B错误;
C、根据上述解答可以Mg和Al各2.5g,对于这两种金属来说硫酸的量不足,即硫酸完全反应,所以生成氢气的质量相等所以反应完毕,天平平衡,故C正确;
D、根据上述解答可以知道2.3gNa和2.4gMg,2.3gNa质量差为2.3-0.1=2.2g,而2.4gMg质量差为2.4g-0.2g=2.2g,天平平衡,故D正确;
故选CD.
点评 此题考查的是活泼金属与酸反应的性质,重点要把金属活动顺序表背过,分清哪种金属和酸反应哪种金属和酸不反应,另外要能根据酸和金属反应的来判断等质量的金属哪个放出的氢气多.

①液态水变成水蒸气 ②酸碱中和反应 ③浓H2SO4稀释 ④固体NaOH溶于水 ⑤H2在Cl2中燃烧 ⑥氯化铵与八水合氢氧化钡反应.
| A. | ①②③④⑤ | B. | ②⑤⑥ | C. | ③④⑤ | D. | ②⑤ |
| A. | 将盐卤或石膏加入豆浆中制豆腐 | |
| B. | 钢笔同时使用两种不同牌号的蓝黑墨水,易出现堵塞 | |
| C. | 向氯化铁溶液中加入氢氧化钠溶液出现红褐色沉淀 | |
| D. | 在河水与海水的交界处,易形成三角洲 |
| A. | 金属活动性B>A | |
| B. | 还原性B>A | |
| C. | 在后者装置中金属A发生还原反应,金属B发生氧化反应 | |
| D. | 金属B的表面上明显有气泡产生,金属A表面无气泡 |
| A. | 氢氧化铜与硫酸溶液反应 OH-+H+═H2O | |
| B. | 铁与稀硫酸反应 2Fe+6H+═2Fe3++3H2↑ | |
| C. | 铁和硫酸铜溶液反应 Fe+Cu2+═Cu+Fe2+ | |
| D. | 碳酸钙与盐酸溶液反应 CO32-+2H+═H2O+CO2↑ |
| A. | 增大H2O2的浓度 | B. | 加入少量MnO2粉末 | ||
| C. | 加入几滴FeCl3溶液 | D. | 把盛有H2O2溶液的试管放在冰水里 |
 .
.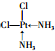 .
.