题目内容
18.天然气是一种很重要的清洁能源,其主要成分为CH4.下列说法正确的是( )| A. | 常温常压下CH4是液体 | B. | 一氯甲烷分子式为CH4Cl | ||
| C. | CH4与Cl2可以发生加成反应 | D. | CH4完全燃烧生成CO2和H2O |
分析 A.依据甲烷常温下为气体的物理性质解答;
B.一氯甲烷中含有1个C,3个H,1个Cl;
C.甲烷中碳原子为饱和结构;
D.依据甲烷中含有碳、氢两种元素解答.
解答 解:A.甲烷常温下为气体,故A错误;
B.一氯甲烷中含有1个C,3个H,1个Cl,分子式为:CH3Cl,故B错误;
C.甲烷中碳原子为饱和结构,不能发生加成反应,故C错误;
D.甲烷中含有碳、氢两种元素,完全燃烧生成二氧化碳和水,故D正确;
故选:D.
点评 本题考查了甲烷的性质,熟悉甲烷的结构及物理、化学性质是解题关键,题目难度不大.

练习册系列答案
相关题目
6.短周期元素X、Y、Z、W在周期表中的位置关系如表所示.已知在同周期元素的常见简单离子中,W的离子半径最小,X、Y、Z、W的单质及其化合物在日常生活中用途极其广泛.
(1)X元素在元素周期表中的位置是第二周第ⅣA族.
(2)X、Y、Z元素的氢化物均有两种或两种以上.
液态YH3的电离方式与液态H2Z类似,则液态YH3中阴离子的电子式为
(3)以W为材料制成的容器在空气中具有自我保护作用,这种容器不能贮存强碱溶液,用离子方程式表示其原因为Al2O3+2OH-=2AlO2-+H2O、2Al+2OH-+2H2O=2AlO2-+3H2↑.
(4)超细WY粉末被应用于大规模集成电路领域.其制作原理为W2Z3、Y2、X在高温下反应生成两种化合物,这两种化合物均由两种元素组成,且原子个数比均为1:l;其反应的化学方程式为Al2O3+N2+3C $\frac{\underline{\;高温\;}}{\;}$2AlN+3CO.
| X | Y | Z | |
| W |
(2)X、Y、Z元素的氢化物均有两种或两种以上.
液态YH3的电离方式与液态H2Z类似,则液态YH3中阴离子的电子式为

(3)以W为材料制成的容器在空气中具有自我保护作用,这种容器不能贮存强碱溶液,用离子方程式表示其原因为Al2O3+2OH-=2AlO2-+H2O、2Al+2OH-+2H2O=2AlO2-+3H2↑.
(4)超细WY粉末被应用于大规模集成电路领域.其制作原理为W2Z3、Y2、X在高温下反应生成两种化合物,这两种化合物均由两种元素组成,且原子个数比均为1:l;其反应的化学方程式为Al2O3+N2+3C $\frac{\underline{\;高温\;}}{\;}$2AlN+3CO.
13.下列离子方程式正确的是( )
| A. | 氢氧化铜与硫酸溶液反应 OH-+H+═H2O | |
| B. | 铁与稀硫酸反应 2Fe+6H+═2Fe3++3H2↑ | |
| C. | 铁和硫酸铜溶液反应 Fe+Cu2+═Cu+Fe2+ | |
| D. | 碳酸钙与盐酸溶液反应 CO32-+2H+═H2O+CO2↑ |
3.化学家认为石油、煤作为能源使用时,燃烧了“未来的原始材料”.下列观点正确的是( )
| A. | 大力提倡开发化石燃料作为能源 | |
| B. | 研发新型催化剂,提高石油和煤中各组分的燃烧热 | |
| C. | 化石燃料属于可再生能源,不影响可持续发展 | |
| D. | 人类应尽可能开发新能源,取代化石能源 |
8.用NA表示阿伏加德罗常数的数值,下列叙述正确的是( )
| A. | 常温下,14 g乙烯中含碳原子数为NA | |
| B. | 1 mol NH4+与1 mol OH-所含的电子数均为10NA | |
| C. | 常温常压下,22.4L CH4中含C-H键数目为4NA | |
| D. | 常温下,pH=13的NaOH溶液中含OH-数目为0.1NA |
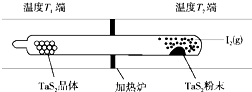 化学反应原理在科研和生产中有广泛应用.
化学反应原理在科研和生产中有广泛应用. )常用于调制具有草莓、葡萄、樱桃、香子兰等香味的食用香精.
)常用于调制具有草莓、葡萄、樱桃、香子兰等香味的食用香精.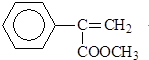 .
.
 .
.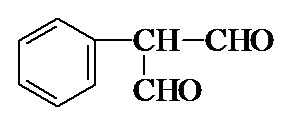 .
.