题目内容
19.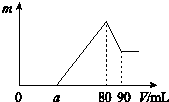 把一定质量的镁、铝混合物投入到2mol•L-1的盐酸中,待金属完全溶解后,向溶液中加入2mol•L-1的氢氧化钠溶液,生成沉淀的质量与加入氢氧化钠溶液的体积关系如图所示.
把一定质量的镁、铝混合物投入到2mol•L-1的盐酸中,待金属完全溶解后,向溶液中加入2mol•L-1的氢氧化钠溶液,生成沉淀的质量与加入氢氧化钠溶液的体积关系如图所示.(1)金属铝的质量为0.54g.
(2)a的取值范围是0≤a<50.
(3)盐酸的体积是80mL.
(4)$\frac{n(Mg)}{n(Al)}$的最大值是2.5.
(5)80~90mL对应反应的离子方程式Al(OH)3+OH-=AlO2-+2H2O.
分析 0~a段没有生成沉淀,说明盐酸过量,加入的氢氧化钠与氯化氢反应;a~80段开始生成沉淀,加入80mL氢氧化钠溶液后沉淀达到最大量,此时溶液中的溶质为NaCl;80~90段氢氧化铝开始溶解,溶解氢氧化铝消耗了10mLNaOH,则氢氧化铝沉淀的物质的量为:2mol/L×0.01L=0.02mol;当加入90mLNaOH溶液后氢氧化铝完全溶解,此时沉淀只有氢氧化镁.
(1)氢氧化钠的体积在80至90mL段内,所有的氢氧化钠用于溶解氢氧化铝,根据氢氧化钠的量确定氢氧化铝的量,根据原子守恒确定金属铝的量;
(2)合金的组成可以采用极限假设法,当金属全部是金属铝时剩余的酸最多,a的值最大来判断a得取值范围;
(3)加入80mL氢氧化钠溶液时,溶质为NaCl,根据质量守恒可以计算出氯化氢的物质的量,再根据V=$\frac{n}{c}$计算出盐酸的体积;
(4)根据图象中消耗的氢氧化钠的量确定合金中金属镁的最大量,进而确定该合金中两元素物质的量之比的最大值;
(5)80~90ml对应反应为氢氧化铝与氢氧化钠反应生成偏铝酸钠和水,据此写出反应的离子方程式.
解答 解:0~a段没有生成沉淀,说明盐酸过量,加入的氢氧化钠与氯化氢反应;a~80段开始生成沉淀,加入80mL氢氧化钠溶液后沉淀达到最大量,此时溶液中的溶质为NaCl;80~90段氢氧化铝开始溶解,溶解氢氧化铝消耗了10mLNaOH,则氢氧化铝沉淀的物质的量为:2mol/L×0.01L=0.02mol;当加入90mLNaOH溶液后氢氧化铝完全溶解,此时沉淀只有氢氧化镁.
(1)从横坐标80mL到90mL这段可以得出:n(Al(OH)3)=0.02mol,则n(Al)=n(Al(OH)3)=0.02mol,原混合物中铝的质量为:27g/mol×0.02mol=0.54g,
故答案为:0.54;
(2)假设盐酸溶解金属后没有剩余,此时酸恰好与合金反应完全,即a=0,通过极值法,当合金中完全是铝时,因为沉淀Al3+需要消耗NaOH溶液的体积为30mL,从图可知,中和过量的酸所消耗的碱液体积最大为50mL,但是假设不成立,最大值是不存在的,所以的取值范围为 0≤a<50,
故答案为:0≤a<50;
(3)加入80mL氢氧化钠溶液时,溶质为NaCl,则:n(HCl)=n(NaOH)=2mol/L×0.08L=0.16mol,
盐酸的体积为:$\frac{0.16mol}{2mol/L}$=0.08L=80mL,
故答案为:80;
(4)n(Al)=n(Al(OH)3)=2mol•L-1×0.01L=0.02mol,所以沉淀Al3+需要消耗的OH-为0.06mol,即NaOH溶液的体积为30mL,镁离子和铝离子沉淀完全消耗的碱的体积为(80-a)mL,若假设盐酸没有剩余,所以沉淀Mg2+需要NaOH溶液的体积最大值为:80mL-30mL=50mL,
n (Mg)的最大值为:$\frac{2mol/L×0.05L}{2}$=0.05mol,所以该合金中镁铝两元素物质的量之比的最大值为:0.05mol:0.02mol=2.5,
故答案为:2.5;
(5)根据分析可知,80~90ml对应反应的离子方程式:Al(OH)3+OH-=AlO2-+2H2O,
故答案为:Al(OH)3+OH-=AlO2-+2H2O.
点评 本题考查混合物有关计算,题目难度中等,明确图象各阶段发生的反应羧基解题的关键,注意守恒法在化学计算中的应用.

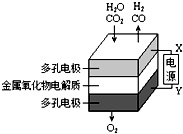 在固态金属氧化物电解池中,高温共电解H2O~CO2混合气体制备H2和CO是一种新的能源利用方式,基本原理如图所示.下列说法不正确的是( )
在固态金属氧化物电解池中,高温共电解H2O~CO2混合气体制备H2和CO是一种新的能源利用方式,基本原理如图所示.下列说法不正确的是( )| A. | X是电源的负极 | |
| B. | 阴极的反应式是:H2O+2eˉ═H2+O2- | |
| C. | 总反应可表示为:H2O+CO2═H2+CO+O2 | |
| D. | 阴、阳两极生成的气体的物质的量之比是2:1 |
| A. | NO2-酸性氧化物 Na2O2-碱性氧化物 Al2O3-两性氧化物 | |
| B. | 盐酸-混合物 胆矾-纯净物 C60-单质 | |
| C. | 纯碱-碱 硫化氢-酸 小苏打-酸式盐 | |
| D. | 液氯-非电解质 硫酸钡-强电解质 醋酸-弱电解质 |
| 阳离子 | Na+、Ba2+、NH4+ |
| 阴离子 | CH3COO-、Cl-、OH-、SO42- |
(1)A是CH3COONa.
(2)25℃时,0.1mol•L-1 B溶液的pH=a,则B溶液中c(H+)-c(NH3•H2O)=1×10(a-14(用含有a的关系式表示).
(3)将等体积、等物质的量浓度的B溶液和C溶液混合,反应后溶液中各种离子浓度由大到小的顺序为c(OH-)> c(Ba2+)= c(Cl-)> c(NH4+)> c(H+).
(4)在一定体积的0.005mol•L-1的C溶液中,加入一定体积的0.001 25mol•L-1的盐酸时,混合溶液的pH=11,若反应后溶液的体积等于C溶液与盐酸的体积之和,则C溶液与盐酸的体积比是1:4.
| A. |  分散系的分类 | |
| B. |  醋酸稀释 | |
| C. | 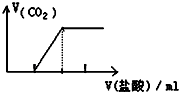 向Na2CO3溶液中逐滴滴入盐酸 | |
| D. | 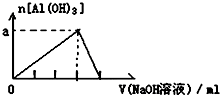 向AlCl3溶液中滴加过量的NaOH溶液 |
| A. | c(Na+)═c(CH3COO-)+c(CH3COOH) | |
| B. | 0.1mol•L-1的CH3COONa溶液中:c(CH3COO-)>c(Na+)>c(OH-)>c(H+) | |
| C. | 将CH3COONa溶解到醋酸中,CH3COONa抑制醋酸的电离 | |
| D. | 等物质的量浓度的CH3COONa、CH3COONH4溶液中c(CH3COO-)不相等 |
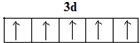 .
.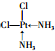 .
.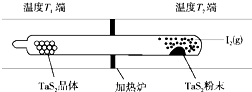 化学反应原理在科研和生产中有广泛应用.
化学反应原理在科研和生产中有广泛应用.