题目内容
1.军事和气象野外作业常用CaH2做为生氢剂,钙与氢气隔绝空气加热可获得CaH2. 现有甲、乙两位同学分别设计了制备纯净CaH2的实验,装置如图1所示(分别以序号Ⅰ、Ⅱ表示.铁架台等夹持固定仪器已略去).请回答下列问题: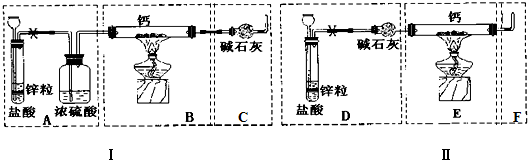
(1)最后实验结果显示,两位同学的实验装置设计都有缺陷.请你两套装罝中选取你认为合理的部分,按从左到右的顺序组装一套制取CaH2的合理装置DBC(用序号A、B、C…表亦)
(2)根据完整的实验装置进行实验,实验步骤如下,请补全必要的实验步骤;
步骤1:检査装置气密性后,装人药品
步骤2:打开弹簧夹,使盐酸与锌粒接触产生气体1
步骤3向装置中通入氢气并在C处收集氢气并检验是否纯净
舟骤4:点燃酒精饤,反应一段时间:
步骤5:停止加热,继续通入氢气使固体充分冷却
步骤6:关闭弹簧夹使盐酸与锌粒分离,停止反应,
(3)离子型金属氢化物,如NaH、CaH2,等,易与水反应产牛氢气.试写出CaH2与水反应的化学反应方程式,并用单线桥表示出电子转移的方向和数目:
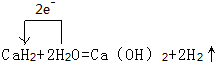 ,结合上述反应,实验结束后,甲同学取少量产物,小心加入水中,观察到有气泡冒出,溶液中加入酚酞后显红色,该同学据此推断,上述实验确有CaH2生成.请你分析该同学的判断是否合理?(填“是”或“否”).若不合理解释原因(若判断合理,此问不用两答)否,金属钙和水反应也有相似的实验现象
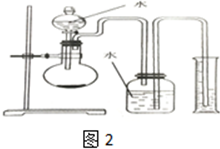
,结合上述反应,实验结束后,甲同学取少量产物,小心加入水中,观察到有气泡冒出,溶液中加入酚酞后显红色,该同学据此推断,上述实验确有CaH2生成.请你分析该同学的判断是否合理?(填“是”或“否”).若不合理解释原因(若判断合理,此问不用两答)否,金属钙和水反应也有相似的实验现象(4)乙同学利用如图2装置,通过测定一定质量固体和足量水反应生成气体的体积来判断是否有CaH2生成.若固体的质量为m g、实验条件下的气体摩尔体枳为a L/mol、滴人到烧瓶中的水的体积为bL,当V(H2)体积为$\frac{mg}{42g/mol}$×aL/mol-bL<V(H2)<$\frac{mg}{40g/mol}×aL/mol$×2-bL 范围时,可说明有CaH2生成.
分析 (1)用锌和稀盐酸制取氢气时,该反应是放热反应,放出的热量使盐酸、水挥发,所以得到的气体中含有氯化氢和水蒸气,为防止HCl和水与Ca反应,则应该先除杂、干燥氢气;加热条件下氢气和Ca反应生成氢化钙,为防止空气中水蒸气和氧气进入硬质试管中,右边连接硬质试管的导气管应该与干燥管相连;
(2)步骤3:在点燃酒精灯之前,应该通入氢气并检验氢气纯度;
步骤5:停止加热,且要防止氢化钙水解和被氧化;
(3)氢化钙和水反应生成氢氧化钙和氢气,该反应中H元素化合价由+1价、-1价变为0价,转移电子数是2;Ca和水反应也生成氢气和氢氧化钙,与氢化钙和水反应产物相同;
(4)根据转移电子守恒知,生成氢气物质的量与钙的物质的量相等,是氢化钙的物质的量2倍,如果只含氢化钙,生成氢气体积=$\frac{mg}{42g/mol}$×aL/mol-bL,如果只含钙,生成氢气体积=$\frac{mg}{40g/mol}×aL/mol$×2-bL.
解答 解:(1)用锌和稀盐酸制取氢气时,该反应是放热反应,放出的热量使盐酸、水挥发,所以得到的气体中含有氯化氢和水蒸气,为防止HCl和水与Ca反应,则应该先除杂、干燥氢气;加热条件下氢气和Ca反应生成氢化钙,为防止空气中水蒸气和氧气进入硬质试管中,右边连接硬质试管的导气管应该与干燥管相连,为达到实验目的,选取的仪器应该是DBC,故答案为:DBC;
(2)步骤3:在点燃酒精灯之前,应该通入氢气并检验氢气纯度,否则易产生爆炸;
步骤5:停止加热,且要防止氢化钙水解和被氧化,所以要继续通入氢气使固体充分冷却,
故答案为:向装置中通入氢气并在C处收集氢气并检验是否纯净;停止加热,继续通入氢气使固体充分冷却;
(3)氢化钙和水反应生成氢氧化钙和氢气,该反应中H元素化合价由+1价、-1价变为0价,转移电子数是2,其转移电子方向和数目为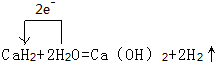 ;Ca和水反应也生成氢气和氢氧化钙,与氢化钙和水反应产物相同,所以不能据此判断含有氢化钙,
;Ca和水反应也生成氢气和氢氧化钙,与氢化钙和水反应产物相同,所以不能据此判断含有氢化钙,
故答案为: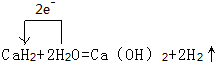 ;否;金属钙和水反应也有相似的实验现象;
;否;金属钙和水反应也有相似的实验现象;
(4)根据转移电子守恒知,生成氢气物质的量与钙的物质的量相等,是氢化钙的物质的量2倍,如果只含氢化钙,生成氢气体积=$\frac{mg}{42g/mol}$×aL/mol-bL,如果只含钙,生成氢气体积=$\frac{mg}{40g/mol}×aL/mol$×2-bL,如果钙和氢化钙都有,则生成氢气体积介于二者之间,故答案为:$\frac{mg}{42g/mol}$×aL/mol-bL<V(H2)<$\frac{mg}{40g/mol}×aL/mol$×2-bL.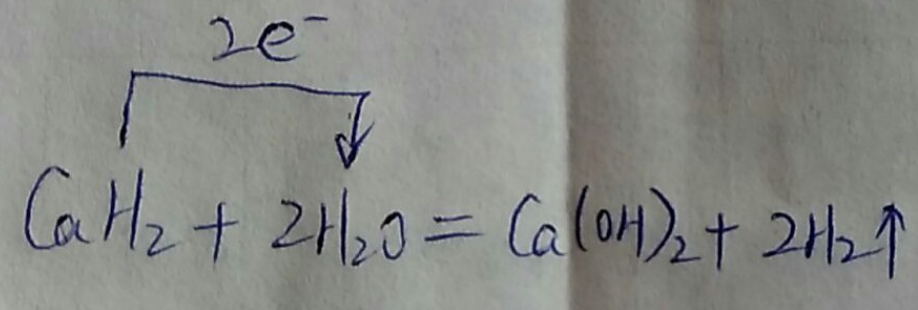
点评 本题考查物质制备,为高频考点,涉及实验基本操作、实验装置选取、化学方程式的计算、氧化还原反应等知识点,侧重考查基本操作、基本理论,明确实验原理及基本操作方法是解本题关键,题目难度不大.

| A. | c(Na+)═c(CH3COO-)+c(CH3COOH) | |
| B. | 0.1mol•L-1的CH3COONa溶液中:c(CH3COO-)>c(Na+)>c(OH-)>c(H+) | |
| C. | 将CH3COONa溶解到醋酸中,CH3COONa抑制醋酸的电离 | |
| D. | 等物质的量浓度的CH3COONa、CH3COONH4溶液中c(CH3COO-)不相等 |
①液态水变成水蒸气 ②酸碱中和反应 ③浓H2SO4稀释 ④固体NaOH溶于水 ⑤H2在Cl2中燃烧 ⑥氯化铵与八水合氢氧化钡反应.
| A. | ①②③④⑤ | B. | ②⑤⑥ | C. | ③④⑤ | D. | ②⑤ |
| A. | 金属活动性B>A | |
| B. | 还原性B>A | |
| C. | 在后者装置中金属A发生还原反应,金属B发生氧化反应 | |
| D. | 金属B的表面上明显有气泡产生,金属A表面无气泡 |
| X | Y | Z | |
| W |
(2)X、Y、Z元素的氢化物均有两种或两种以上.
液态YH3的电离方式与液态H2Z类似,则液态YH3中阴离子的电子式为

(3)以W为材料制成的容器在空气中具有自我保护作用,这种容器不能贮存强碱溶液,用离子方程式表示其原因为Al2O3+2OH-=2AlO2-+H2O、2Al+2OH-+2H2O=2AlO2-+3H2↑.
(4)超细WY粉末被应用于大规模集成电路领域.其制作原理为W2Z3、Y2、X在高温下反应生成两种化合物,这两种化合物均由两种元素组成,且原子个数比均为1:l;其反应的化学方程式为Al2O3+N2+3C $\frac{\underline{\;高温\;}}{\;}$2AlN+3CO.
| A. | 氢氧化铜与硫酸溶液反应 OH-+H+═H2O | |
| B. | 铁与稀硫酸反应 2Fe+6H+═2Fe3++3H2↑ | |
| C. | 铁和硫酸铜溶液反应 Fe+Cu2+═Cu+Fe2+ | |
| D. | 碳酸钙与盐酸溶液反应 CO32-+2H+═H2O+CO2↑ |