题目内容
3.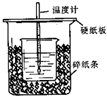 已知稀的酸与稀的碱发生中和反应,生成1mol水所放出的热叫中和热,用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
已知稀的酸与稀的碱发生中和反应,生成1mol水所放出的热叫中和热,用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:(1)从实验装置上看,图中尚缺少的一种玻璃用品是环形玻璃搅拌器.
(2)如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量不相等 (填“相等、不相等”),所求中和热相等(填“相等、不相等”),
(3)已知滇池中学高二一班某同学的实验记录如表,
| 实验次数 | 酸的温度 | 碱的温度 | 反应最高温度 |
| 1 | 21.5℃ | 20.5℃ | 24.3℃ |
| 2 | 21.5℃ | 21.5℃ | 25.0℃ |
| 3 | 16.0℃ | 18.5℃ | 21.5℃ |
(4)用相同浓度和体积的氨水(NH3•H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会偏小;(填“偏大”、“偏小”、“无影响”).
分析 (1)根据量热计的构造来判断该装置的缺少仪器;
(2)反应放出的热量和所用酸以及碱的量的多少有关,并根据中和热的概念和实质来回答;
(3)先根据表中测定数据计算出混合液反应前后的平均温度差,再根据Q=m•c•△T计算出反应放出的热量,然后计算出生成1mol水放出的热量,就可以得到中和热;
(4)根据弱电解质电离吸热分析.
解答 解:(1)根据量热计的构造可知该装置的缺少仪器是环形玻璃搅拌器,故答案为:环形玻璃搅拌器;
(2)反应放出的热量和所用酸以及碱的量的多少有关,如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,生成水的量增多,所放出的热量偏高,但是中和热的均是强酸和强碱反应生成1mol水时放出的热,与酸碱的用量无关,所以用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行上述实验,测得中和热数值相等;
故答案为:不相等;相等;
(3)第1次实验盐酸和NaOH溶液起始平均温度为21℃,反应后温度为:24.3℃,温度差为:3.3℃;
第2次实验盐酸和NaOH溶液起始平均温度为21.5℃,反应后温度为:25.0℃,温度差为:3.5℃;
第3次实验盐酸和NaOH溶液起始平均温度为17.25℃,反应后温度为:21.5℃,温度差为:4.25℃;
第3组误差较大,舍去,其他三两次温度差平均值为3.4℃;
用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液,生成水的物质的量为0.05L×0.50mol/L=0.025mol,溶液的质量为100mL×1g/ml=100g,则生成0.025mol水放出的热量为Q=m•c•△T=100g×4.17J/(g•℃)×3.4℃=1417.8J,即1.4178KJ,所以实验测得的中和热△H=-$\frac{1.4178KJ}{0.025mol}$=-56.8kJ/mol;
故答案为:-56.8kJ/mol;
(4)一水合氨为弱碱,电离过程为吸热过程,用相同浓度和体积的氨水(NH3•H2O)代替NaOH溶液进行上述实验,测得的中和热的数值偏小;
故答案为:偏小.
点评 本题主要考查热中和热概念、测定原理及反应热的计算,题目难度中等,注意理解中和热的概念以及测定反应热的误差等问题.

| A. | 2H2(g)+O2(g)═2H2O(g)△H1;2H2(g)+O2(g)═2H2O(l)△H2 | |
| B. | S(g)+O2(g)═SO2(g)△H1;S(s)+O2(g)═SO2(g)△H2 | |
| C. | 2SO2(g)+O2(g)═2SO3(g)△H1;2SO3(g)═O2(g)+2SO2(g)△H2 | |
| D. | 已知反应:C(金刚石,s)═C(石墨,s)△H<0,C(金刚石,s)+O2(g)═CO2(g)△H1;C(石墨,s)+O2(g)═CO2(g)△H2 |
| 成分 | 含量(mg•L-1) | 成分 | 含量(mg•L-1) |
| Cl- | 18980 | Ca2+ | 400 |
| Na+ | 10560 | HCO3- | 142 |
| SO42- | 2560 | Br- | 64 |
| Mg2+ | 1272 |
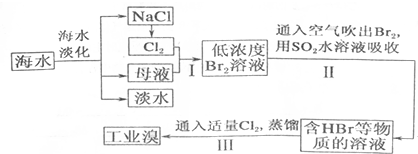
(1)请列举海水淡化的一种方法蒸留法或电渗透法或离子交换法等.
(2)请写出步骤I反应的离子方程式为Cl2+2Br-=Br2+2Cl-.
(3)步骤I中已经获得Br2,步骤II中又将获得的Br2还原为Br-,其目的是富集溴元素.
(4)步骤II用SO2水溶液吸收Br2,吸收率可达95%,该反应的离子方程式为SO2+Br2+2H2O═4H++2Br-+SO42-.
(5)依据上述流程,若将10m3海水中的溴元素转化为工业溴,至少需要标准状况下Cl2的体积为179.2L(忽略Cl2的溶解)
①把贝壳制成生石灰;
②在海水中加入生石灰,过滤、洗涤沉淀物;
③将沉淀物与盐酸反应,结晶、过滤;
④在氯化氢热气流中加热晶体;
⑤电解上述所得盐(熔融条件下).
下列说法正确的是( )
| A. | 向洗涤液中滴加氯化钙溶液可检验沉淀是否洗涤干净 | |
| B. | 上述变化过程中包括了分解、化合、复分解、置换等四种反应类型 | |
| C. | 步骤④在氯化氢热气流中加热晶体的目的是为了防止氯化镁水解 | |
| D. | 步骤⑤也可以采用电解该盐水溶液的方法 |
| A. | CO2 | B. | HCl | C. | NH3 | D. | NaCl |
①2.24L氨气含有NA个电子
②1.4g乙烯与丙烯的混合气体含有NA个碳原子
③精炼铜,若阳极失去2NA个电予.则阴极增重64g
④标准状况下,22.4L空气含有NA个分子
⑤过氧化钠与水反应.若电子转移2NA,则产生的氧气为32g
⑥将IL2mol/L的FeCl3溶液加人到沸水中.加热使之完全反应.所得氢氧化铁子数为2NA
⑦在1L0.1mol/L的碳酸钠溶液中.阴离子总数大于0.1NAA.
| A. | ③④⑤⑦ | B. | ①③④⑦ | C. | ②③④⑤⑦ | D. | ②④⑤⑦ |
| A. | 0.3molNO2、0.1molNO | B. | 0.6molNO | ||
| C. | 0.3molNO、0.1molNO2 | D. | 0.2molNO2、0.2molNO |
 和
和 F.
F. 和CH2=CH-CH3G.
和CH2=CH-CH3G.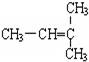 和
和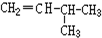
 ,偏碱性条件下,氰化钠溶液的CN-被双氧水氧化为HCO3-,同时放出NH3,该反应的离子方程式为CN-+H2O2+H2O═NH3↑+HCO3-.
,偏碱性条件下,氰化钠溶液的CN-被双氧水氧化为HCO3-,同时放出NH3,该反应的离子方程式为CN-+H2O2+H2O═NH3↑+HCO3-.