题目内容
8.设NA为阿伏加德罗常数的数值.则下列说怯中正确的是①2.24L氨气含有NA个电子
②1.4g乙烯与丙烯的混合气体含有NA个碳原子
③精炼铜,若阳极失去2NA个电予.则阴极增重64g
④标准状况下,22.4L空气含有NA个分子
⑤过氧化钠与水反应.若电子转移2NA,则产生的氧气为32g
⑥将IL2mol/L的FeCl3溶液加人到沸水中.加热使之完全反应.所得氢氧化铁子数为2NA
⑦在1L0.1mol/L的碳酸钠溶液中.阴离子总数大于0.1NAA.
| A. | ③④⑤⑦ | B. | ①③④⑦ | C. | ②③④⑤⑦ | D. | ②④⑤⑦ |
分析 ①根据没有告诉是标准状况下判断;
②根据乙烯和丙烯的实验式计算出混合气体中含有的实验式的物质的量;
③根据电子守恒计算出阴极生成铜的质量;
④根据标况下的气体摩尔体积计算出空气中含有的分子数;
⑤根据过氧化钠中氧元素为-1价分析生成氧气的物质的量及质量;
⑥根据氢氧化铁胶体是氢氧化铁的聚集体判断;
⑦根据碳酸钠溶液中碳酸根离子水解生成氢氧根离子分析.
解答 解:①没有告诉是标准状况下,题中条件无法计算氨气的物质的量,故①错误;
②乙烯和丙烯的最简式为CH2,1.4g混合气体中含有0.1mol实验式,含有0.1mol碳原子,含有0.1NA个碳原子,故②错误;
③精炼铜,若阳极失去2NA个电子,阴极铜离子得到2mol电子生成1mol铜,则阴极增重64g,故③正确;
④标准状况下,22.4L空气的物质的量为1mol,含有NA个分子,故④正确;
⑤过氧化钠与水反应,若电子转移2NA,转移了2mol电子,能够生成1mol氧气,则产生的氧气为32g,故⑤正确;
⑥将1L 2mol/L 的FeCl3溶液加入到沸水中,加热使之完全反应,由于氢氧化铁胶体是氢氧化铁的聚集体,无法计算含有的胶体粒子数,故⑥错误;
⑦在1L 0.1mol/L的碳酸钠溶液中,含有溶质碳酸钠0.1mol,由于碳酸根离子部分水解,导致溶液中阴离子数目增多,所以溶液中阴离子总数大于0.1NA,故⑦正确;
故选A.
点评 本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,阿伏加德罗常数是高考的“热点”,它既考查了学生对物质的量、粒子数、质量、体积等与阿伏加德罗常数关系的理解,又可以涵盖多角度的化学知识内容.要准确解答好这类题目,一是要掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系;二是要准确弄清分子、原子、原子核内质子中子及核外电子的构成关系.

 名校课堂系列答案
名校课堂系列答案| A. | 被保护的金属与电源的正极相连 | |
| B. | 被保护的金属表面上不发生氧化反应,也不发生还原反应 | |
| C. | 在被保护的金属表面上发生氧化反应 | |
| D. | 被保护的金属与电源的负极相连 |
| A. | 放电过程中KOH的物质的量浓度不变 | |
| B. | 负极反应为14H2O+7O2+28e-=28OH- | |
| C. | 放电一段时间后,负极周围的pH升高 | |
| D. | 每消耗1mol C2H6,则电路上转移的电子为14mol |
| A. | 液化天然气(LNG)和罐装液化石油气(LPG)主要成分都属于烃类 | |
| B. | 煤经过干馏可以得到焦炭和煤焦油等产品,分馏煤焦油可以获得多种芳香烃 | |
| C. | 石油裂化的主要目的是提高轻质液体燃料的产量和质量 | |
| D. | 石油的分馏、煤的液化、煤的气化属于物理变化 |
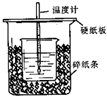 已知稀的酸与稀的碱发生中和反应,生成1mol水所放出的热叫中和热,用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
已知稀的酸与稀的碱发生中和反应,生成1mol水所放出的热叫中和热,用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:(1)从实验装置上看,图中尚缺少的一种玻璃用品是环形玻璃搅拌器.
(2)如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量不相等 (填“相等、不相等”),所求中和热相等(填“相等、不相等”),
(3)已知滇池中学高二一班某同学的实验记录如表,
| 实验次数 | 酸的温度 | 碱的温度 | 反应最高温度 |
| 1 | 21.5℃ | 20.5℃ | 24.3℃ |
| 2 | 21.5℃ | 21.5℃ | 25.0℃ |
| 3 | 16.0℃ | 18.5℃ | 21.5℃ |
(4)用相同浓度和体积的氨水(NH3•H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会偏小;(填“偏大”、“偏小”、“无影响”).
| A. | 使pH试纸显深蓝色的溶液:Na+、K+、I-、NO${\;}_{3}^{-}$ | |
| B. | 0.1mol•L-1的Ca(ClO)2溶液:K+、Na+、I-、Cl- | |
| C. | 能使甲基橙显红色的溶液:K+、Fe2+、Cl-、NO${\;}_{3}^{-}$ | |
| D. | 加KSCN显红色的溶液:Na+、Mg2+、I-、SO${\;}_{4}^{2-}$ |
 四种短周期元素在周期表中的相对位置如下所示,其中Y元素原子最外层电子数是其电子层数的3倍.
四种短周期元素在周期表中的相对位置如下所示,其中Y元素原子最外层电子数是其电子层数的3倍.| X | Y | |
| Z | W |
(1)元素W的最高价氧化物对应的水化物的化学式为HClO4;
(2)这些元素的氢化物中,水溶液碱性最强的化合物是NH3.H2O或NH3(写化学式);
(3)X、Y、Z、W形成的简单阴离子半径大小顺序为S2->Cl->N3->O2-(用离子符号填空);证明W的非金属性比强Z的最简单方法是H2S+Cl2=S+2HCl(用化学方程式填空);
(4)Z的低价氧化物通入W的单质形成的水溶液中反应的化学方程式:SO2+Cl2+2H2O=H2SO4+2HCl;
(5)Z的低价氧化物能与Y的单质在一定体积的密闭容器反应,该反应属于可逆反应(填“可逆反应”或“非可逆反应”),反应速率与时间关系如图所示,t1到t2反应速率逐渐加快的原因是浓度变化不明显,反应放热,温度升高,反应速率加快,在t3(填“t1”“t2”或“t3”)时达到平衡;对该反应,下列说法正确的是AC.
A.Y的单质是氧化剂
B.混合气体的密度不再改变,可以判断反应达到平衡状态
C.Z的低价氧化物能使品红褪色
D.反应达到平衡状态时,反应停止
(6)将一定量的W单质通入30mL浓度为10.00mol/L的氢氧化钠浓溶液中,加热少许时间后溶液中形成NaW、NaWO、NaWO3共存体系,则消耗的W单质的物质的量为0.15mol.
 重铬酸钾(K2Cr2O7)是一种重要的氧化剂,可以检验司机是否酒后驾驶.
重铬酸钾(K2Cr2O7)是一种重要的氧化剂,可以检验司机是否酒后驾驶.