题目内容
15.在15.2g铁和铜的合金中加入过量的硝酸溶液,合金完全溶解,同时生成气体X,再向所得溶液中加入足量的NaOH溶液,生成25.4g沉淀,则下列X的组成合理的是( )| A. | 0.3molNO2、0.1molNO | B. | 0.6molNO | ||
| C. | 0.3molNO、0.1molNO2 | D. | 0.2molNO2、0.2molNO |
分析 15.2g铁和铜组成的合金中加入过量的硝酸溶液,合金完全溶解,生成硝酸铁、硝酸铜,向所得溶液中加入足量的NaOH溶液,生成25.4g沉淀为氢氧化铁、氢氧化铜的总质量,则沉淀中氢氧根的质量=25.4g-15.2g=10.2g,根据电荷守恒可知,金属提供电子物质的量等于氢氧根物质的量,根据电子转移守恒计算判断.
解答 解:15.2g铁和铜组成的合金中加入过量的硝酸溶液,合金完全溶解,生成硝酸铁、硝酸铜,向所得溶液中加入足量的NaOH溶液,生成25.4g沉淀为氢氧化铁、氢氧化铜的总质量,则沉淀中氢氧根的质量=25.4g-15.2g=10.2g,n(OH-)=$\frac{10.2g}{17g/mol}$=0.6molmol,根据电荷守恒可知,金属提供电子物质的量等于氢氧根物质的量,即金属提供电子物质的量为0.6mol,
A.若生成0.3mol NO2、0.1mol NO,则转移电子为0.3mol×(5-4)+0.1mol×(5-2)=0.6mol,电子转移守恒,故A正确;
B.若生成0.6mol NO,则转移电子为0.6mol×(5-2)=1.8mol,电子转移不守恒,故B错误;
C.若生成0.3mol NO、0.1mol NO2,则转移电子为0.3mol×(5-2)+0.1mol×(5-4)=1mol,电子转移不守恒,故C错误;
D.若生成0.2molNO2、0.2molNO,则转移电子为0.2mol×(5-4)+0.2mol×(5-2)=0.8mol,电子转移不守恒,故D错误,
故选A.
点评 本题考查混合物有关有关计算,关键是判断金属提供电子物质的量等于氢氧根物质的量,注意守恒思想的应用,难度中等.

练习册系列答案
相关题目
6. 早在1807年化学家戴维用电解熔融氢氧化钠制得钠:4NaOH(熔)$\frac{\underline{\;电解\;}}{\;}$4Na+O2↑+2H2O;后来盖•吕萨克用铁与熔融氢氧化钠作用也制得钠:3Fe+4NaOH$\frac{\underline{\;1100℃\;}}{\;}$Fe3O4+2H2↑+4Na↑.下列有关说法正确的是( )
早在1807年化学家戴维用电解熔融氢氧化钠制得钠:4NaOH(熔)$\frac{\underline{\;电解\;}}{\;}$4Na+O2↑+2H2O;后来盖•吕萨克用铁与熔融氢氧化钠作用也制得钠:3Fe+4NaOH$\frac{\underline{\;1100℃\;}}{\;}$Fe3O4+2H2↑+4Na↑.下列有关说法正确的是( )
 早在1807年化学家戴维用电解熔融氢氧化钠制得钠:4NaOH(熔)$\frac{\underline{\;电解\;}}{\;}$4Na+O2↑+2H2O;后来盖•吕萨克用铁与熔融氢氧化钠作用也制得钠:3Fe+4NaOH$\frac{\underline{\;1100℃\;}}{\;}$Fe3O4+2H2↑+4Na↑.下列有关说法正确的是( )
早在1807年化学家戴维用电解熔融氢氧化钠制得钠:4NaOH(熔)$\frac{\underline{\;电解\;}}{\;}$4Na+O2↑+2H2O;后来盖•吕萨克用铁与熔融氢氧化钠作用也制得钠:3Fe+4NaOH$\frac{\underline{\;1100℃\;}}{\;}$Fe3O4+2H2↑+4Na↑.下列有关说法正确的是( )| A. | 电解熔融氢氧化钠制钠,阳极发生电解反应2OH--2e-═H2↑+O2↑ | |
| B. | 盖•吕萨克法制钠原理是利用铁的还原性比钠强 | |
| C. | 若戴维法与盖•吕萨克法制得等量的钠,则两反应中转移的电子总数不同 | |
| D. | 目前工业上常用电解熔融氯化钠法制钠(如上图),电解槽中石墨极为阴极,铁为阳极 |
3.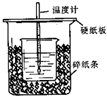 已知稀的酸与稀的碱发生中和反应,生成1mol水所放出的热叫中和热,用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
已知稀的酸与稀的碱发生中和反应,生成1mol水所放出的热叫中和热,用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃用品是环形玻璃搅拌器.
(2)如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量不相等 (填“相等、不相等”),所求中和热相等(填“相等、不相等”),
(3)已知滇池中学高二一班某同学的实验记录如表,
请根据有用数据计算中和热(酸碱的密度均视为1g/ml,C=4.17J/g.℃)-56.8kJ/mol
(4)用相同浓度和体积的氨水(NH3•H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会偏小;(填“偏大”、“偏小”、“无影响”).
 已知稀的酸与稀的碱发生中和反应,生成1mol水所放出的热叫中和热,用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
已知稀的酸与稀的碱发生中和反应,生成1mol水所放出的热叫中和热,用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:(1)从实验装置上看,图中尚缺少的一种玻璃用品是环形玻璃搅拌器.
(2)如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量不相等 (填“相等、不相等”),所求中和热相等(填“相等、不相等”),
(3)已知滇池中学高二一班某同学的实验记录如表,
| 实验次数 | 酸的温度 | 碱的温度 | 反应最高温度 |
| 1 | 21.5℃ | 20.5℃ | 24.3℃ |
| 2 | 21.5℃ | 21.5℃ | 25.0℃ |
| 3 | 16.0℃ | 18.5℃ | 21.5℃ |
(4)用相同浓度和体积的氨水(NH3•H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会偏小;(填“偏大”、“偏小”、“无影响”).
10.NA表示阿伏加德罗常数,下列说法正确的是( )
| A. | 1mol的羟基与1mol的氢氧根离子所含电子数均为9NA | |
| B. | 500mL0.1mol/L盐酸中,含有HCl分子数目为0.05NA | |
| C. | 1molNa被氧化生成NaNO3水溶液或NaCl,都失去NA个电子 | |
| D. | 1.0L1.0mol•L-1的NaNO3水溶液中含有的氧原子数为3NA |
20.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 使pH试纸显深蓝色的溶液:Na+、K+、I-、NO${\;}_{3}^{-}$ | |
| B. | 0.1mol•L-1的Ca(ClO)2溶液:K+、Na+、I-、Cl- | |
| C. | 能使甲基橙显红色的溶液:K+、Fe2+、Cl-、NO${\;}_{3}^{-}$ | |
| D. | 加KSCN显红色的溶液:Na+、Mg2+、I-、SO${\;}_{4}^{2-}$ |
7.用铂作电极电解相同浓度的盐酸和硫酸,一段时间后,下列说法正确的是( )
| A. | 盐酸和硫酸的浓度都增大 | B. | 盐酸和硫酸的浓度都减大 | ||
| C. | 盐酸的浓度减小,硫酸的浓度增大 | D. | 盐酸的浓度增大,硫酸的浓度减小 |
14.分子式为C5H10O3并能使新制Cu(OH)2悬浊液溶解,继续加热会出现砖红色沉淀的有机物有(不含立体异构)( )
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
15.在一定条件下,不是可逆反应A(g)+3B(g)?2C(g)达到平衡标志的为( )
| A. | C生成速率与C分解速率相等 | B. | A、B、C的浓度不再变化 | ||
| C. | A、B、C的物质的量之比为1:3:2 | D. | 体系压强不再变化 |
 ;
;