题目内容
2.一定量的Fe和Fe2O3的混合物投入250ml密度为1.065g.cm-3、物质的量浓度为2mol•L-1的HNO3溶液中,固体恰好完全溶解,生成Fe(NO3)2和1.12LNO(标况下,且假定HNO3还原产物仅此一种).向反应后的溶液中加入1mol•L-1NaOH溶液,使铁元素完全沉淀下来,下列说法正确的是( )| A. | 混合物中含有0.05molFe元素 | |
| B. | 该硝酸溶液中溶质的质量分数是63% | |
| C. | 所加入NaOH溶液的体积最少是450mL | |
| D. | 反应中HNO3被氧化,生成氧化产物NO |
分析 标准状况下1.12L NO的物质的量为:$\frac{1.12L}{22.4L/mol}$=0.05mol,250mL 2mol/L的硝酸溶液中含有硝酸的物质的量为:2mol/L×0.25L=0.5mol,
A.固体恰好完全溶解,生成Fe(NO3)2和1.12LNO,反应后溶液中硝酸根离子的物质的量为:0.5mol-0.05mol=0.45mol,根据N元素守恒可知Fe元素的物质的量;
B.250mL该稀硝酸溶液的质量为:1.065g.cm-3×250mL=266.25g,据此计算出该稀硝酸的质量分数;
C.亚铁离子完全沉淀时,反应后溶质为硝酸钠,反应后溶液中硝酸根离子的物质的量为:0.5mol-0.05mol=0.45mol,则至少消耗0.45mol氢氧化钠,根据V=$\frac{n}{c}$计算出消耗氢氧化钠溶液的体积;
D.反应中硝酸的化合价降低,发生还原反应,不是被氧化.
解答 解:标准状况下1.12L NO的物质的量为:$\frac{1.12L}{22.4L/mol}$=0.05mol,250mL 2mol/L的硝酸溶液中含有硝酸的物质的量为:2mol/L×0.25L=0.5mol,
A.固体恰好完全溶解,生成Fe(NO3)2和1.12LNO,反应后溶液中硝酸根离子的物质的量为:0.5mol-0.05mol=0.45mol,根据N元素守恒可知Fe元素的物质的量为:$\frac{0.45mol}{2}$=0.225mol,故A错误;
B.250mL该稀硝酸溶液的质量为:1.065g.cm-3×250mL=266.25g,则该稀硝酸的质量分数为:$\frac{0.5mol×63g/mol}{266.25g}$×100%=11.8%,故B错误;
C.亚铁离子完全沉淀时,反应后溶质为硝酸钠,反应后溶液中硝酸根离子的物质的量为:0.5mol-0.05mol=0.45mol,则至少消耗0.45mol氢氧化钠,所加入NaOH溶液的体积最少是:$\frac{0.45mol}{1mol/L}$=0.45L=450mL,故C正确;
D.反应中硝酸的化合价降低被还原,NO为还原产物,故D错误;
故选C.
点评 本题考查了混合物反应的计算,题目难度中等,明确发生反应的实质为解答关键,注意掌握守恒思想在化学计算中的应用,试题培养了学生的分析能力及化学计算能力.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| ① | ② | ③ | ④ |
| 0.1mol/L 盐酸 | pH=3 盐酸 | 0.1mol/L 氨水 | pH=11 氨水 |
| A. | 由水电离出的c(H+):①>③ | |
| B. | ③稀释到原来的100倍后,pH与④相同 | |
| C. | ①与③混合,若溶液pH=7,则V(盐酸)>V(氨水) | |
| D. | ②与④混合,若溶液显碱性,则所得溶液中离子浓度可能为:c(NH4+)>c(OH-)>c(Cl-)>c(H+) |
| A. | 氯气与明矾处理水的原理完全相同 | |
| B. | 从海水中提取物质都必须通过化学反应才能实现 | |
| C. | 植物通过光合作用将二氧化碳转化为糖是太阳能转变成热能的过程 | |
| D. | 铝比铁活泼,但铝制品比铁制品在空气中耐腐蚀 |
| A. | 青铜的熔点比纯铜和锡都高 | B. | 陶瓷的主要成分为硅酸盐 | ||
| C. | 古代的纸张主要成分为蛋白质 | D. | 黑火药爆炸时,氧化剂只有硝酸钾 |
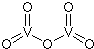
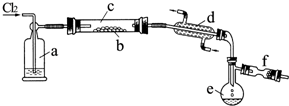 氯化硫(S2Cl2)是一种黄红色液体,有刺激性、窒息性恶臭,熔点为-80℃,沸点137.1℃.在空气中强烈发烟,易与水发生水解反应.人们使用它作橡胶硫化剂,使橡胶硫化,改变生橡胶热发粘冷变硬的不良性能.在熔融的硫中通入氯气即可生成S2Cl2.如图是实验室用S和Cl2制备S2Cl2的装置(夹持装置、加热装置均已略去).
氯化硫(S2Cl2)是一种黄红色液体,有刺激性、窒息性恶臭,熔点为-80℃,沸点137.1℃.在空气中强烈发烟,易与水发生水解反应.人们使用它作橡胶硫化剂,使橡胶硫化,改变生橡胶热发粘冷变硬的不良性能.在熔融的硫中通入氯气即可生成S2Cl2.如图是实验室用S和Cl2制备S2Cl2的装置(夹持装置、加热装置均已略去).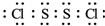 .
. 铬、钒、镨(Pr)、铈(Ce)等金属在工农业生产中有广泛的应用.
铬、钒、镨(Pr)、铈(Ce)等金属在工农业生产中有广泛的应用.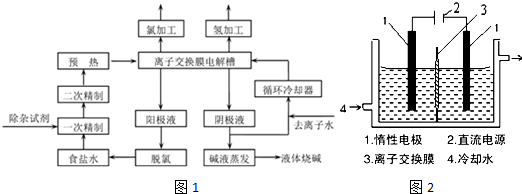

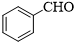 .
. .
.