题目内容
17.NA代表阿伏加德罗常数,下列说法中正确的是( )| A. | 0.1mol/LFeCl3溶液中,Fe3+的物质的量一定小于0.1NA | |
| B. | 6.6gCO2分子中含的共用电子对数为0.6NA | |
| C. | 标准状况下,22.4LNO和11.2L02混合后气体的分子总数为NA | |
| D. | 6.4g铜与足量的硫充分反应,则转移的电子教为0.2N |
分析 A.缺少溶液体积,无法计算铁离子的物质的量;
B.二氧化碳分子中含有4对共用电子对,根据n=$\frac{m}{M}$计算出二氧化碳的物质的量,再计算出含有电子数;
C.二氧化氮与四氧化二氮中存在转化平衡,导致反应后气体总分子数减少;
D.铜与S反应生成的是氯化亚铜,6.4g铜的物质的量为0.1mol,完全反应后失去0.1mol电子.
解答 解:A.没有告诉0.1mol/LFeCl3溶液的体积,无法计算溶液中含有铁离子的数目,故A错误;
B.6.6g二氧化碳的物质的量为:$\frac{6.6g}{44g/mol}$=0.15mol,二氧化碳的电子式为 ,则0.15mol二氧化碳分子中含有共用电子对的物质的量为:0.15mol×4=0.6mol,含有的共用电子对数为0.6NA,故B正确;
,则0.15mol二氧化碳分子中含有共用电子对的物质的量为:0.15mol×4=0.6mol,含有的共用电子对数为0.6NA,故B正确;
C.标准状况下,22.4LNO的物质的量为:$\frac{22.4L}{22.4L/mol}$=1mol,11.2L氧气的物质的量为:$\frac{11.2L}{22.4L/mol}$=0.5mol,二者恰好反应生成1mol二氧化氮,由于部分二氧化氮转化成四氧化二氮,导致反应后气体分子数减少,所以混合后气体的分子总数小于NA,故C错误;
D.6.4g铜的物质的量为:$\frac{6.4g}{64g/mol}$=0.1mol,0.1mol铜与硫反应生成0.05mol氯化亚铜,转移了0.1mol电子,转移的电子教为0.2NA,故D错误;
故选B.
点评 本题考查了阿伏伽德罗常数的综合应用,题目难度中等,明确物质的量与阿伏伽德罗常数、摩尔质量之间的关系为解答关键,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案
相关题目
7.设NA为阿伏加德罗常数,下列叙述中正确的是( )
| A. | 标准状况下,22.4L H2中所含质子数、中子数均为2NA | |
| B. | 46g NO2气体和46g N2O4气体的分子数之比为2:1 | |
| C. | 1L 1 mol•L-1的盐酸中所含粒子总数为2NA | |
| D. | 71g氯气与足量铁粉充分反应,转移的电子数为3NA |
5.常温下,下列溶液的pH<7的是( )
| A. | Na2CO3 | B. | NaHCO3 | C. | NaClO | D. | NaHSO3 |
12.在学习了溶液中的离子反应之后,小明同学认为反应中的先后顺序很重要,他们归纳了下面一些情况,在他所作的整理中,你认为正确的是( )
| A. | 向浓度为0.1 mol/L 的FeCl3和CuCl2混合溶液加入铁粉,CuCl2首先反应 | |
| B. | 向(NH4)2Fe(SO4)2溶液中滴加少量的NaOH溶液,NH4+先反应 | |
| C. | 向浓度均为0.1 mol/L的Na2CO3和NaOH混合溶液通入CO2气体,NaOH先反应 | |
| D. | 向浓度均为0.1 mol/L的FeBr2通入少量氯气,Br-首先反应 |
5.某溶液中加入铝粉有氢气产生,该溶液中一定可以大量共存的离子组是( )
| A. | Na+、Fe3+、Cl-、ClO- | B. | Na+、K+、Ba2+、HCO3- | ||
| C. | Mg2+、NH4+、SO42-、Cl- | D. | Na+、K+、Cl-、SO42- |
12. 在如图所示的电解质溶液的导电性装置中,若向某-电解质溶液中逐滴加入另一种溶液时.则灯光由亮变暗至熄灭后又逐渐变亮的是( )
在如图所示的电解质溶液的导电性装置中,若向某-电解质溶液中逐滴加入另一种溶液时.则灯光由亮变暗至熄灭后又逐渐变亮的是( )
 在如图所示的电解质溶液的导电性装置中,若向某-电解质溶液中逐滴加入另一种溶液时.则灯光由亮变暗至熄灭后又逐渐变亮的是( )
在如图所示的电解质溶液的导电性装置中,若向某-电解质溶液中逐滴加入另一种溶液时.则灯光由亮变暗至熄灭后又逐渐变亮的是( )| A. | 盐酸中逐滴加入食盐溶液 | B. | 醋酸中逐滴加入氢氧化钠溶液 | ||
| C. | 氢氧化钡溶液中逐滴加入硫酸溶液 | D. | 醋酸中逐滴加入氨水 |
9.已知:
乙苯催化脱氢制苯乙烯反应: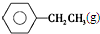 $\stackrel{催化剂}{?}$
$\stackrel{催化剂}{?}$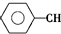 ≡CH2(g)+H2(g)的反应热△H为( )
≡CH2(g)+H2(g)的反应热△H为( )
| 化学键 | C-H | C-C | C═C | H-H |
| 键能/kJ•mol-1 | 412 | 348 | 612 | 436 |
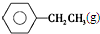 $\stackrel{催化剂}{?}$
$\stackrel{催化剂}{?}$ ≡CH2(g)+H2(g)的反应热△H为( )
≡CH2(g)+H2(g)的反应热△H为( )| A. | -124 kJ/mol | B. | +124 kJ/mol | C. | -40 kJ/mol | D. | +40 kJ/mol |
10.下列各组离子能在水溶液中大量共存的是( )
| A. | K+、H+、SO42-、OH- | B. | Na+、Ca2+、CO32-、NO3- | ||
| C. | Na+、H+、Fe2+、NO3- | D. | Na+、Cu2+、Cl-、SO42- |