题目内容
现将0.40mol A气体和0.20mol B气体充入10L的密闭容器中,在一定条件下使其发生反应生成气体C,其物质的量的变化如图一:
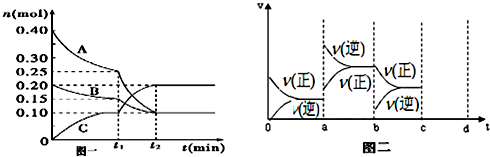
(1)若t1=10min,则0至t1时间内B物质的平均反应速率为 ;
(2)该反应在t2时达到平衡,其化学方程式为 .
(3)已知上述反应的△H<0,在t2时达到平衡后,由于条件改变而引起反应速度和化学平衡的变化情况如图二,则a~b过程中改变的条件可能是 ;b~c过程中改变的条件可能是 .
(4)在b~c过程后,若增大压强,请将反应速度的变化情况画在图二中的c~d处.

(1)若t1=10min,则0至t1时间内B物质的平均反应速率为
(2)该反应在t2时达到平衡,其化学方程式为
(3)已知上述反应的△H<0,在t2时达到平衡后,由于条件改变而引起反应速度和化学平衡的变化情况如图二,则a~b过程中改变的条件可能是
(4)在b~c过程后,若增大压强,请将反应速度的变化情况画在图二中的c~d处.
考点:物质的量或浓度随时间的变化曲线
专题:化学平衡专题
分析:(1)根据v=
计算反应速率;
(2)根据反应中各物质的变化的物质的量之比等于计量数之比,可写出化学方程式;
(3)根据影响化学反应速率和化学平衡的条件可作判断;
(4)根据压强对化学反应速率的影响可画出相关的图;
| △c |
| △t |
(2)根据反应中各物质的变化的物质的量之比等于计量数之比,可写出化学方程式;
(3)根据影响化学反应速率和化学平衡的条件可作判断;
(4)根据压强对化学反应速率的影响可画出相关的图;
解答:
解:(1)t1=10min,0至t1时间内B物质的平均反应速率为
=
=5.0×10-4mol-1min-1,故答案为:5.0×10-4mol-1min-1;
(2)根据图一可知,A、B的物质的量在减小,为反应物,C的物质的量增加,为生成物,且有△n(A)=0.40mol-0.10mol=0.30mol,△n(B)=0.20mol-0.10mol=0.10mol,△n(C)=0.20mol-0mol=0.20mol,再根据反应中各物质的变化的物质的量之比等于计量数之比,可写出化学方程式为3A(g)+B(g)?2C(g),
故答案为:3A(g)+B(g)?2C(g);
(3)根据图二可知,在a时刻,正逆反应速率都增大,且逆反应速率大于正反应速率,即平衡逆向移动,因为反应的△H<0,根据影响化学反应速率和化学平衡的条件可知,a~b过程中改变的条件可能是升温;在b时刻,正反应速率 不变,逆反应速率减小,且正反应速率大于逆反应速率,即平衡正向移动,根据影响化学反应速率和化学平衡的条件可知,b~c过程中改变的条件可能是减小生成物C的浓度,
故答案为:升温,减小生成物C的浓度;
(4)在b~c过程后,若增大压强,正逆反应速率都会增大,由于该反应为体积缩小的反应,所以平衡正向移动,根据压强对化学反应速率的影响可画出相关的图为: ,
,
故答案为: .
.
| △c |
| △t |
| ||
| 10min |
(2)根据图一可知,A、B的物质的量在减小,为反应物,C的物质的量增加,为生成物,且有△n(A)=0.40mol-0.10mol=0.30mol,△n(B)=0.20mol-0.10mol=0.10mol,△n(C)=0.20mol-0mol=0.20mol,再根据反应中各物质的变化的物质的量之比等于计量数之比,可写出化学方程式为3A(g)+B(g)?2C(g),
故答案为:3A(g)+B(g)?2C(g);
(3)根据图二可知,在a时刻,正逆反应速率都增大,且逆反应速率大于正反应速率,即平衡逆向移动,因为反应的△H<0,根据影响化学反应速率和化学平衡的条件可知,a~b过程中改变的条件可能是升温;在b时刻,正反应速率 不变,逆反应速率减小,且正反应速率大于逆反应速率,即平衡正向移动,根据影响化学反应速率和化学平衡的条件可知,b~c过程中改变的条件可能是减小生成物C的浓度,
故答案为:升温,减小生成物C的浓度;
(4)在b~c过程后,若增大压强,正逆反应速率都会增大,由于该反应为体积缩小的反应,所以平衡正向移动,根据压强对化学反应速率的影响可画出相关的图为:
 ,
,故答案为:
 .
.
点评:本题考查了根据图象写化学方程式、计算反应速率及影响反应速率和化学平衡移动的外界因素等知识,难度不大,在看图二时要注间线的起点和正逆反应速率的相对大小,进而判断平衡移动方向.

练习册系列答案
 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案
相关题目
已知强酸和强碱在稀溶液中发生中和反应生成1molH2O(l)时放出57.30kJ热量,用500mL0.60mol/L
H2SO4溶液与200mL5mol/LNaOH溶液完全反应,放出的热量是( )
H2SO4溶液与200mL5mol/LNaOH溶液完全反应,放出的热量是( )
| A、68.76kJ |
| B、57.30 kJ |
| C、34.38kJ |
| D、17.19 kJ |
在强酸性溶液中能大量共存,并且溶液为无色透明的离子组是( )
| A、NH4+、Al3+、SO42-、NO3- |
| B、K+、NH4+、MnO4-、SO42- |
| C、Na+、OH-、NO3-、HCO3- |
| D、K+、Cu2+、CH3COO-、NO3- |


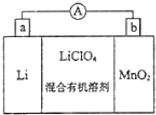 锰锂电池的体积小、性能优良,是常用的一次电池.该电池反应原理如图所示,其中电解质LiClO4溶于混合有机溶剂中,Li+通过电解质迁移入MnO2晶格中,生成LiMnO2.回答下列问题:
锰锂电池的体积小、性能优良,是常用的一次电池.该电池反应原理如图所示,其中电解质LiClO4溶于混合有机溶剂中,Li+通过电解质迁移入MnO2晶格中,生成LiMnO2.回答下列问题: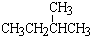 ; ⑧CH3CH2CH2CH3与CH3CH(CH3)2
; ⑧CH3CH2CH2CH3与CH3CH(CH3)2
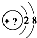 某同学在画某种元素的一种单核微粒的结构示意图时,忘记在圆圈内标出其质子数,请你根据下面的提示做出自己的判断.
某同学在画某种元素的一种单核微粒的结构示意图时,忘记在圆圈内标出其质子数,请你根据下面的提示做出自己的判断.