题目内容
18.镁铝合金5.1g完全溶于过量的热浓硝酸中,反应中共产生11.2LNO2(标准状况下测定),若在反应后溶液中加入足量的氢氧化钠溶液,则生成沉淀质量为( )| A. | 7.8 g | B. | 13.6 g | C. | 5.8g | D. | 4g |
分析 标况下11.2L二氧化氮的物质的量为:n(NO2)=$\frac{11.2L}{22.4L/mol}$=0.5mol,根据氮元素的化合价变化计算转移电子物质的量;氢氧化钠溶液过量,则最后沉淀为Mg(OH)2,利用金属总质量、电子守恒列式计算出镁的物质的量,再计算出生成氢氧化镁的质量.
解答 解:标况下11.2L二氧化氮的物质的量为:n(NO2)=$\frac{11.2L}{22.4L/mol}$=0.5mol,生成0.5mol二氧化氮转移电子的物质的量为0.5mol×(5-4)=0.5mol,
设Al的物质的量为x、Mg的物质的量为y,则①3x+2y=0.5;
根据合金的总质量可得:②27x+24y=5.1g,
根据①②解得:x=0.1mol、y=0.1mol,
即:合金中含有0.1mol镁;
加入过量氢氧化钠溶液后生成的沉淀只能为氢氧化镁,根据质量守恒可知生成氢氧化镁的物质的量为0.1mol,质量为:58g/mol×0.1mol=5.8g,
故选C.
点评 本题考查混合物反应的计算,题目难度中等,明确反应实质为解答关键,注意掌握质量守恒、电子守恒在 化学计算中的应用方法,试题培养了学生的化学计算能力.

练习册系列答案
相关题目
19.某工厂用如图所示的流程图除去工业废气中含有的H2S,下列说法中正确的是( )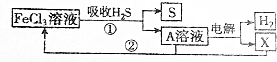

| A. | A溶液中溶质的成分为FeCl2 | B. | X为Cl2并且在阴极上生成的 | ||
| C. | 废气中的H2S最终转化为S和H2 | D. | 只有流程①为氧化还原反应 |
9.下列物质中,属于天然高分子化合物的是( )
| A. | 塑料制品 | B. | 天然油脂 | C. | 棉花 | D. | 人造橡胶 |
6.下列描述及热化学方程式均正确的是( )
| A. | 已知C2H6的燃烧热为1090 kJ•mol-1,则C2H6燃烧的热化学方程式为:C2H6(g)+3.5O2(g)═2CO2(g)+3H2O(g)△H=-1090 kJ/mol | |
| B. | 25℃,101kPa下,l mol C6H6燃烧生成CO2和液态水时放出3260 kJ热量,其热化学方程式为:C6H6(g)+7.5O2(g)=6CO2(g)+3H2O (l)△H=-3260kJ•mol-1 | |
| C. | 已知常温下:H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ/mol,则稀醋酸与稀NaOH溶液反应生成1 mol H2O(l)时也放出57.3 kJ的热量 | |
| D. | 已知2CO(g)+O2(g)═2CO2(g)△H=-566 kJ•mol-1,则CO的燃烧热△H=-283 kJ•mol-1 |
13.草酸合铁(Ⅲ)酸钾晶体[KxFe y(C2O4)z•nH2O]是一种光敏材料,为测定该晶体中各离子的含量和结晶水的含量,某实验小组实验步骤为:(1)称量9.820g草酸合铁酸钾晶体,加热脱水得无水物质量为8,74g.(2)将所得固体配制成250mL溶液.(3)取所配溶液25.00mL于锥形瓶中,滴加酸性KMnO4溶液发生反应:5C2O42-+2MnO4-+16H+=10CO2↑+2Mn2++8H2O,恰好消耗0.1000mol/L KMnO4溶液24.00mL.下列说法正确的是( )
| A. | 9.820g晶体中含有C2O42-的物质的量为0.006mol | |
| B. | 配制草酸合铁酸钾溶液玻璃仪器只需烧杯和玻璃棒 | |
| C. | 该晶体的化学式为K3Fe(C2O4)3•6H2O | |
| D. | 9.820g样品中含K+的物质的量为0.06 mol |
10.在一定条件下MnO4-与SO32-反应产物是Mn2+,则与1molMnO4-反应所需SO32-的物质的量为( )
| A. | 3.0mol | B. | 2.5mol | C. | 1.0mol | D. | 0.75mol |
7.原予序数依次增大的四种短周期元素X、Y、Z、W,X元素组成的单质在自然界中硬度最大,Y元素的原子最外层电子数是次外层电子数的三倍,W元素与Y元素组成的化合物既能与酸反应又能与碱反应,Z元素的原子最外层只有一个电子.下列叙述错误的是( )
| A. | 元素金属性:Z>W | |
| B. | X与Y可形成多种共价化合物 | |
| C. | 化合物Z2Y2中既含离子键,又含共价键 | |
| D. | Y元素只能形成一种单质 |
 已知H2CO3的Ka1=4.2×10-7、Ka2=5.6×10-11;HClO的Ka=3.0×10-8,HF的Ka=3.5×10-4.
已知H2CO3的Ka1=4.2×10-7、Ka2=5.6×10-11;HClO的Ka=3.0×10-8,HF的Ka=3.5×10-4.