题目内容
13.草酸合铁(Ⅲ)酸钾晶体[KxFe y(C2O4)z•nH2O]是一种光敏材料,为测定该晶体中各离子的含量和结晶水的含量,某实验小组实验步骤为:(1)称量9.820g草酸合铁酸钾晶体,加热脱水得无水物质量为8,74g.(2)将所得固体配制成250mL溶液.(3)取所配溶液25.00mL于锥形瓶中,滴加酸性KMnO4溶液发生反应:5C2O42-+2MnO4-+16H+=10CO2↑+2Mn2++8H2O,恰好消耗0.1000mol/L KMnO4溶液24.00mL.下列说法正确的是( )| A. | 9.820g晶体中含有C2O42-的物质的量为0.006mol | |
| B. | 配制草酸合铁酸钾溶液玻璃仪器只需烧杯和玻璃棒 | |
| C. | 该晶体的化学式为K3Fe(C2O4)3•6H2O | |
| D. | 9.820g样品中含K+的物质的量为0.06 mol |
分析 A、根据化合价变化,高锰酸钾中的锰原子化合价降低,被还原,C2O42-全部转化成CO2,化合价变化+3→+4,根据电子守恒计算;
B、必须使用到250mL的容量瓶和胶头滴管;
C、根据电子守恒计算出C2O42- 的物质的量,再求出三草酸合铁酸钾的质量,计算出结晶水的物质的量,得出分子式即可;
D、根据求算出的02molK3Fe(C2O4)3的物质的量结合分子式计算钾离子的物质的量.
解答 解:A、高锰酸钾得到电子等于C2O42-失去的电子,n得=0.1000mol/L×0.024L×(7-2)=0.012mol;C2O42-全部转化成CO2,化合价变化+3→+4,根据电子守恒 n(C2O42-)=$\frac{0.012mol}{(2-1)×2}$=0.006mol,故A正确;
B、需要配制成250mL溶液,必须使用到250容量瓶和胶头滴管,故B错误;
C、高锰酸钾得到电子等于C2O42-失去的电子,n得=0.1000mol/L×0.024L×(7-2)=0.012mol;C2O42-全部转化成CO2,化合价变化+3→+4,根据电子守恒 n(C2O42-)=$\frac{0.012mol}{(2-1)×2}$=0.006mol;250mL原溶液C2O42-的物质的量为0.006mol×10=0.06mol,故n[K3Fe(C2O4)3]=0.06mol×$\frac{1}{3}$=0.02mol,9.820g三草酸合铁酸钾晶体中结晶水的质量为:9.820-8.74=1.08(g),故n(H2O)=$\frac{1.08g}{18g/mol}$=0.06mol,即0.02molK3Fe(C2O4)3中还有0.06molH2O,结晶水数目为3,故该晶体的化学式为K3Fe(C2O4)3•3H2O,故C错误;
D、9.820g样品即0.02molK3Fe(C2O4)3中含K+的物质的量为0.06mol,故D正确.
故选AD.
点评 本题借助滴定,考查学生分析、理解信息能力及计算能力,该题难度稍大,需要耐心分析题中数据.

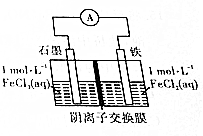
| A. | FeCl3和FeCl2可以互换位置,对反应无影响 | |
| B. | 该电池总反应为FeCl3+Fe═2FeCl2 | |
| C. | 若溶解2.8g铁,约有0.1molCl-从交换膜左向右迁移 | |
| D. | 一段时间后,阴膜左、右侧离子数变化量之比约为2:3 |
| A. | 氧化物 | B. | 酸 | C. | 碱 | D. | 盐 |
| A. | 7.8 g | B. | 13.6 g | C. | 5.8g | D. | 4g |
| A. | 由于碘在酒精中的溶解度大,所以可用酒精把碘水中的碘萃取出来 | |
| B. | 蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处 | |
| C. | 使用容量瓶前检查它是否漏水 | |
| D. | 蒸发操作时,不能使混合物中的水分完全蒸干后才停止加热 |
(1)叠氮化钠(NaN3)受撞击完成分解产生钠和氮气,故可应用于汽车安全气囊.若产生40.32L(标准状况下)氮气,至少需要叠氮化钠78g.
(2)钠-钾合金可在核反应堆中用作热交换液.5.05g钠-钾合金溶于200mL水生成0.075mol氢气.
①计算溶液中氢氧根离子的物质的量浓度0.75mol/L(忽略溶液体积变化).
②计算并确定该钠-钾合金的化学式NaK2.
(3)氢氧化钠溶液处理铝土矿并过滤,得到含铝酸钠的溶液.向该溶液中通入二氧化碳,有下列反应:2NaAl(OH)4+CO2→2Al(OH)3↓+Na2CO3+H2O
已知通入二氧化碳336L(标准状况下),生成24mol Al(OH)3和15mol Na2CO3,若通入溶液的二氧化碳为112L(标准状况下),计算生成的 Al(OH)3和Na2CO3的物质的量之比为4:5
(4)常温下,称取不同氢氧化钠样品溶于水,加盐酸中和至pH=7,然后将溶液蒸干得氯化钠晶体,蒸干过程中产品无损失.
| 氢氧化钠质量(g) | 氯化钠质量(g) | |
| ① | 2.40 | 3.51 |
| ② | 2.32 | 2.34 |
| ③ | 3.48 | 3.51 |
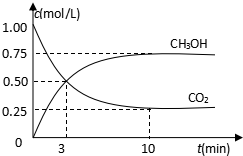 随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视.目前工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,现进行如下实验,在485℃时,在体积为1L的密闭容器中,充入1ol CO2和3mol H2,一定条件下发生反应合成甲醇:
随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视.目前工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,现进行如下实验,在485℃时,在体积为1L的密闭容器中,充入1ol CO2和3mol H2,一定条件下发生反应合成甲醇: ,AE3的分子立体构型为三角锥形;AE3分子在潮湿空气中能水解生成一种常用的漂白剂X和一种能使紫色石蕊变蓝色的气体Y,完成反应方程式:NCl3+3H2O=3HClO+NH3.
,AE3的分子立体构型为三角锥形;AE3分子在潮湿空气中能水解生成一种常用的漂白剂X和一种能使紫色石蕊变蓝色的气体Y,完成反应方程式:NCl3+3H2O=3HClO+NH3.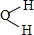 .
.