��Ŀ����
����������Ҫ������Դ��������Ϊ�������õĹؼ��������ǵ�ǰ��ע���ȵ�֮һ��
��1�������������Դ����ȼ�ղ���Ϊ ��
��2��NaBH4��һ����Ҫ�Ĵ������壬����ˮ��Ӧ����NaBO2���ҷ�Ӧǰ��B�Ļ��ϼ۲��䣬�÷�Ӧ�Ļ�ѧ����ʽΪ ����Ӧ����1mol NaBH4ʱת�Ƶĵ�����ĿΪ ��
��3������ɽ����л�������û�����ͱ�֮��Ŀ��淴Ӧ��ʵ������ͼ��⣮
 ��g��
��g��
 ��g��+3H2��g��
��g��+3H2��g��
��ij�¶��£�������ܱ������м��뻷���飬����ʼŨ��Ϊamol?L-1��ƽ��ʱ����Ũ��Ϊbmol?L-1���÷�Ӧ��ƽ�ⳣ��K=
��4��һ�������£���ͼ��ʾװ�ÿ�ʵ���л���ĵ绯ѧ���⣨���������л����
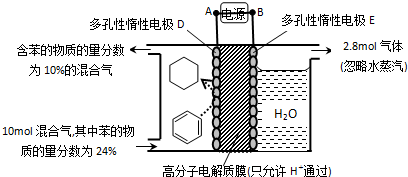
�ٵ����е���ת�Ʒ���Ϊ ������A��D��ʾ��
������Ŀ�����ĵ缫��ӦʽΪ ��
�۸ô���װ�õĵ���Ч�ʦ�= ������=
��100%������������С�����1λ����
��1�������������Դ����ȼ�ղ���Ϊ
��2��NaBH4��һ����Ҫ�Ĵ������壬����ˮ��Ӧ����NaBO2���ҷ�Ӧǰ��B�Ļ��ϼ۲��䣬�÷�Ӧ�Ļ�ѧ����ʽΪ
��3������ɽ����л�������û�����ͱ�֮��Ŀ��淴Ӧ��ʵ������ͼ��⣮
 ��g��
��g��| Pt-Sn/Al2O3 |
| ���� |
 ��g��+3H2��g��
��g��+3H2��g����ij�¶��£�������ܱ������м��뻷���飬����ʼŨ��Ϊamol?L-1��ƽ��ʱ����Ũ��Ϊbmol?L-1���÷�Ӧ��ƽ�ⳣ��K=
��4��һ�������£���ͼ��ʾװ�ÿ�ʵ���л���ĵ绯ѧ���⣨���������л����

�ٵ����е���ת�Ʒ���Ϊ
������Ŀ�����ĵ缫��ӦʽΪ
�۸ô���װ�õĵ���Ч�ʦ�=
| ����Ŀ��������ĵĵ����� |
| ת�Ƶĵ������� |
���㣺ԭ��غ͵��صĹ���ԭ��,������ԭ��Ӧ�ĵ���ת����Ŀ����,�����Դ,��ѧƽ��ļ���
ר�⣺������ԭ��Ӧר��,��ѧƽ��ר��,�绯ѧר��
��������1��������ȫȼ������H2O��
��2��NaBH4��ˮ��Ӧ����NaBO2���ҷ�Ӧǰ��B�Ļ��ϼ۲��䣬HԪ�ػ��ϼ���-1�ۡ�+1�۱�Ϊ0�ۣ��ٽ��ת�Ƶ����غ���ƽ����ʽ������NaBH4��ת�Ƶ���֮��Ĺ�ϵʽ���㣻
��3����ѧƽ�ⳣ��K=
��
��4���ٸ���ͼ֪�����е�̼�õ������ɻ����飬��D��������E������������A�Ƿֽ⡢B�����������ӴӸ�������������
�ڸ�ʵ���Ŀ���Ǵ��⣬���������Ϸ����ķ�ӦΪ����Ŀ���������ϱ��õ��Ӻ����������ɻ����飻
������������������ͬʱ���������ӣ������ϱ��õ��Ӻ������ӷ�Ӧ���ɻ����飬���μӷ�Ӧ��Ҫ���ӵ����ʵ�������ת�Ƶ��ӵ����ʵ���֮�Ⱦ��ǵ���Ч�ʦǣ�
��2��NaBH4��ˮ��Ӧ����NaBO2���ҷ�Ӧǰ��B�Ļ��ϼ۲��䣬HԪ�ػ��ϼ���-1�ۡ�+1�۱�Ϊ0�ۣ��ٽ��ת�Ƶ����غ���ƽ����ʽ������NaBH4��ת�Ƶ���֮��Ĺ�ϵʽ���㣻
��3����ѧƽ�ⳣ��K=
| c(C6H6)��c3(H2) |
| c(C6H12) |
��4���ٸ���ͼ֪�����е�̼�õ������ɻ����飬��D��������E������������A�Ƿֽ⡢B�����������ӴӸ�������������
�ڸ�ʵ���Ŀ���Ǵ��⣬���������Ϸ����ķ�ӦΪ����Ŀ���������ϱ��õ��Ӻ����������ɻ����飻
������������������ͬʱ���������ӣ������ϱ��õ��Ӻ������ӷ�Ӧ���ɻ����飬���μӷ�Ӧ��Ҫ���ӵ����ʵ�������ת�Ƶ��ӵ����ʵ���֮�Ⱦ��ǵ���Ч�ʦǣ�
���
�⣺��1��������ȫȼ������H2O���ʴ�Ϊ��H2O��
��2��NaBH4��ˮ��Ӧ����NaBO2���ҷ�Ӧǰ��B�Ļ��ϼ۲��䣬NaBO2��BԪ�ػ��ϼ�Ϊ+3�ۣ�����NaBH4��HԪ�صĻ��ϼ�Ϊ-1�ۣ�����HԪ�ػ��ϼ���-1�ۡ�+1�۱�Ϊ0�ۣ��ٽ��ת�Ƶ����غ���ƽ����ʽΪNaBH4+2H2O=NaBO2+4H2������Ӧ����1mol NaBH4ʱת�Ƶ����ʵ���=1mol��4����1-0��=4mol������ת�Ƶ�����Ϊ4NA��2.408��1024���ʴ�Ϊ��NaBH4+2H2O=NaBO2+4H2����4NA��2.408��1024��
��3�����������ʼŨ��Ϊamol?L-1��ƽ��ʱ����Ũ��Ϊbmol?L-1��ͬһ�����и����ʷ�Ӧ�����ʵ���Ũ��֮�ȵ����������֮�ȣ����Ը��ݷ���ʽ֪���������ƽ��Ũ��Ϊ��a-b��mol/L��������Ũ��Ϊ3bmol/L����ƽ�ⳣ��K=
mol3?L-3=
=
mol3?L-3��
�ʴ�Ϊ��
mol3?L-3��
��4���ٸ���ͼ֪�����е�̼�õ������ɻ����飬��D��������E������������A�Ƿֽ⡢B�����������ӴӸ����������������Ե��Ӵ�A����D���ʴ�Ϊ��A��D��
�ڸ�ʵ���Ŀ���Ǵ��⣬���������Ϸ����ķ�ӦΪ����Ŀ���������ϱ��õ��Ӻ����������ɻ����飬�缫��ӦʽΪC6H6+6H++6e-=C6H12���ʴ�Ϊ��C6H6+6H++6e-=C6H12��
�����������������ӷŵ���������������������2.8mol����ת�Ƶ��ӵ����ʵ���=2.8mol��4=11.2mol��
����1mol����ʱ����2mol������������2.8mol����ʱͬʱ����5.6mol������
��μӷ�Ӧ�ı������ʵ�����xmol���μӷ�Ӧ�����������ʵ�����3xmol��ʣ�౽�����ʵ���Ϊ10mol��24%-xmol����Ӧ�ĺ���=
��100%=10%��
x=1.2����ת��Ϊ������ת�Ƶ��ӵ����ʵ���Ϊ1.2mol��6=7.2mol����
��100%=64.3%��
�ʴ�Ϊ��64.3%��
��2��NaBH4��ˮ��Ӧ����NaBO2���ҷ�Ӧǰ��B�Ļ��ϼ۲��䣬NaBO2��BԪ�ػ��ϼ�Ϊ+3�ۣ�����NaBH4��HԪ�صĻ��ϼ�Ϊ-1�ۣ�����HԪ�ػ��ϼ���-1�ۡ�+1�۱�Ϊ0�ۣ��ٽ��ת�Ƶ����غ���ƽ����ʽΪNaBH4+2H2O=NaBO2+4H2������Ӧ����1mol NaBH4ʱת�Ƶ����ʵ���=1mol��4����1-0��=4mol������ת�Ƶ�����Ϊ4NA��2.408��1024���ʴ�Ϊ��NaBH4+2H2O=NaBO2+4H2����4NA��2.408��1024��
��3�����������ʼŨ��Ϊamol?L-1��ƽ��ʱ����Ũ��Ϊbmol?L-1��ͬһ�����и����ʷ�Ӧ�����ʵ���Ũ��֮�ȵ����������֮�ȣ����Ը��ݷ���ʽ֪���������ƽ��Ũ��Ϊ��a-b��mol/L��������Ũ��Ϊ3bmol/L����ƽ�ⳣ��K=
| c(C6H6)?c3(H2) |
| c(C6H12) |
| b��(3b)3 |
| (a-b) |
| 27b4 |
| a-b |
�ʴ�Ϊ��
| 27b4 |
| a-b |
��4���ٸ���ͼ֪�����е�̼�õ������ɻ����飬��D��������E������������A�Ƿֽ⡢B�����������ӴӸ����������������Ե��Ӵ�A����D���ʴ�Ϊ��A��D��
�ڸ�ʵ���Ŀ���Ǵ��⣬���������Ϸ����ķ�ӦΪ����Ŀ���������ϱ��õ��Ӻ����������ɻ����飬�缫��ӦʽΪC6H6+6H++6e-=C6H12���ʴ�Ϊ��C6H6+6H++6e-=C6H12��
�����������������ӷŵ���������������������2.8mol����ת�Ƶ��ӵ����ʵ���=2.8mol��4=11.2mol��
����1mol����ʱ����2mol������������2.8mol����ʱͬʱ����5.6mol������
��μӷ�Ӧ�ı������ʵ�����xmol���μӷ�Ӧ�����������ʵ�����3xmol��ʣ�౽�����ʵ���Ϊ10mol��24%-xmol����Ӧ�ĺ���=
| 10mol��24%-x |
| 10mol-3xmol+5.6mol |
x=1.2����ת��Ϊ������ת�Ƶ��ӵ����ʵ���Ϊ1.2mol��6=7.2mol����
| 7.2mol |
| 11.2mol |
�ʴ�Ϊ��64.3%��
���������⿼���˻�ѧƽ�⡢����ԭ����֪ʶ�㣬���ݻ�ѧƽ�ⳣ������ʽ�����ԭ����֪ʶ������������ѵ��ǣ�4���ۣ�ע�⣺10mol����24%-10%�����Dzμӷ�Ӧ�ı������ʵ�����Ϊ�״��㣮

��ϰ��ϵ�д�
 ȫ�ܲ��һ���þ�ϵ�д�
ȫ�ܲ��һ���þ�ϵ�д�
�����Ŀ
25��ʱ�������й���Һ���������ʵ���Ũ�ȹ�ϵ��ȷ���ǣ�������
| A��0.1mol?L-1 CH3COONa��Һ��0.1mol?L-1 HCl��Һ�������ϣ�c��Na+��=c��Cl-����c��CH3COO-����c��OH-�� | ||
| B��0.1mol?L-1 NH4Cl��Һ��0.1mol?L-1��ˮ�������ϣ�pH��7����c��NH3?H2O����c��NH4+����c��Cl-����c��OH-�� | ||
C��0.1mol?L-1 Na2CO3��Һ��0.1mol?L-1 NaHCO3��Һ�������ϣ�
| ||
| D��0.1mol?L-1 Na2C2O4��Һ��0.1mol?L-1 HCl��Һ�������ϣ�H2C2O4Ϊ��Ԫ���ᣩ��2c��C2O42-��+c��HC2O4-��+c��OH-��=c��Na+��+c��H+�� |
����Һ��X
��H2O2���Ӹ�����Ϊ2��5ʱ����Һ��X
������XԪ��ǡ�ñ���ԭΪ�ϵͼ�̬����XԪ�صĻ��ϼ�Ϊ��������
| O | - 4 |
| O | - 4 |
| A��+1 | B��+2 | C��+3 | D��+4 |
�����йص������Һ������Ũ�ȹ�ϵ��ȷ���ǣ�������
| A��pH=1��NaHSO4��Һ��c��H+��=c��SO42-��+c��OH-�� |
| B������AgCl��AgI���������Һ��c��Ag+����c��Cl-��=c��I-�� |
| C��CO2��ˮ��Һ��c��H+����c��HCO3-��=2c��CO32-�� |
| D���������ʵ���NaHC2O4��Na2C2O4����Һ��3c��Na+��=2[c��HC2O4-��+c��C2O42-��+c��H2C2O4��] |
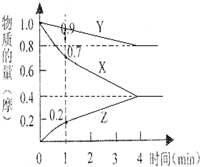 ��1��ij�¶�ʱ��2L���ܱ�������X��Y��Z�������ʵ����ʵ�����ʱ��ı仯��ͼ��ʾ����ͼ�����ݷ������÷�Ӧ�Ļ�ѧ����ʽΪ
��1��ij�¶�ʱ��2L���ܱ�������X��Y��Z�������ʵ����ʵ�����ʱ��ı仯��ͼ��ʾ����ͼ�����ݷ������÷�Ӧ�Ļ�ѧ����ʽΪ
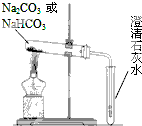 ̼���ƣ�Na2CO3����̼�����ƣ�NaHCO3��������Ϊʳ�ü
̼���ƣ�Na2CO3����̼�����ƣ�NaHCO3��������Ϊʳ�ü ijЩ�Ͼ����Ͽɲ������з����������������ϸ���������ǿ�ȣ�ʹ�������õ����ʣ�ʵ��װ����ͼ������ij�����ϵõ��IJ��������
ijЩ�Ͼ����Ͽɲ������з����������������ϸ���������ǿ�ȣ�ʹ�������õ����ʣ�ʵ��װ����ͼ������ij�����ϵõ��IJ��������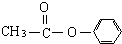 ��
��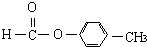 ������֣���ֱ�д���ṹ��ʽ��
������֣���ֱ�д���ṹ��ʽ��