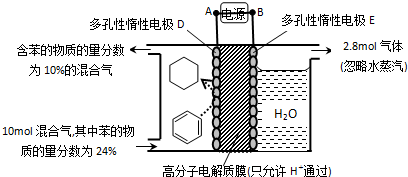
题目内容
下列有关电解质溶液中粒子浓度关系正确的是( )
| A、pH=1的NaHSO4溶液:c(H+)=c(SO42-)+c(OH-) |
| B、含有AgCl和AgI固体的悬浊液:c(Ag+)>c(Cl-)=c(I-) |
| C、CO2的水溶液:c(H+)>c(HCO3-)=2c(CO32-) |
| D、含等物质的量NaHC2O4和Na2C2O4的溶液:3c(Na+)=2[c(HC2O4-)+c(C2O42-)+c(H2C2O4)] |
考点:离子浓度大小的比较,弱电解质在水溶液中的电离平衡,盐类水解的应用
专题:电离平衡与溶液的pH专题,盐类的水解专题
分析:A、NaHSO4溶液中存在氢离子守恒分析判断;
B、AgCl和AgI固体的悬浊液中氯化银溶解度大于碘化银;
C、二氧化碳的水溶液中碳酸分步电离,第二步电离微弱;
D、依据溶液中元素物料守恒计算分析.
B、AgCl和AgI固体的悬浊液中氯化银溶解度大于碘化银;
C、二氧化碳的水溶液中碳酸分步电离,第二步电离微弱;
D、依据溶液中元素物料守恒计算分析.
解答:
解:A、NaHSO4溶液中存在质子守恒分析,硫酸氢钠电离出钠离子、氢离子、硫酸根离子,NaHSO4 =Na++H++SO42-,H2O?H++OH-,溶液中质子守恒,c(H+)=c(SO42-)+c(OH-),故A正确;
B、AgCl和AgI固体的悬浊液中氯化银溶解度大于碘化银,c(Ag+)>c(Cl-)>c(I-),故B错误;
C、二氧化碳的水溶液中碳酸分步电离,第二步电离微弱,H2CO3?H++HCO3-,HCO3-?H++CO32-,c(H+)>c(HCO3-)>2c(CO32-),故C错误;
D、依据溶液中元素物料守恒计算,含等物质的量NaHC2O4和Na2C2O4的溶液:2c(Na+)=3[c(HC2O4-)+C(C2O42-)+c(H2C2O4)],故D错误;
故选A.
B、AgCl和AgI固体的悬浊液中氯化银溶解度大于碘化银,c(Ag+)>c(Cl-)>c(I-),故B错误;
C、二氧化碳的水溶液中碳酸分步电离,第二步电离微弱,H2CO3?H++HCO3-,HCO3-?H++CO32-,c(H+)>c(HCO3-)>2c(CO32-),故C错误;
D、依据溶液中元素物料守恒计算,含等物质的量NaHC2O4和Na2C2O4的溶液:2c(Na+)=3[c(HC2O4-)+C(C2O42-)+c(H2C2O4)],故D错误;
故选A.
点评:本题考查了电解质溶液中电离平衡分析,沉淀溶解平衡的理解应用,电解质溶液中物料守恒,质子守恒的分析判断,掌握基础是关键,题目难度中等.

练习册系列答案
相关题目
甲、乙两烧杯中各盛有200mL的相同浓度的盐酸和氢氧化钠溶液,向两烧杯中分别各加入5.4g的铝粉,反应结束后测得生成的气体体积比为甲:乙=1:2,则盐酸的物质的量浓度为( )
| A、1mol/L |
| B、1.5mol/L |
| C、2mol/L |
| D、2.5mol/L |
四联苯 的一氯代物有( )
的一氯代物有( )
 的一氯代物有( )
的一氯代物有( )| A、3种 | B、4种 | C、5种 | D、6种 |
下列各组物质用括号内试剂加以鉴别,其中不合理的是( )
| A、Na2CO3溶液和Na2SO4溶液(稀盐酸) |
| B、CO2和H2(澄清石灰水) |
| C、NH4Cl溶液和(NH4)2SO4溶液(氢氧化钡溶液) |
| D、Na2CO3溶液和NaHCO3溶液(氢氧化钙溶液) |
下列各操作中,正确的是( )
| A、为减缓反应速率,用饱和食盐水与电石反应制乙炔 |
| B、进行酸碱中和滴定时,锥形瓶应用待测液润洗 |
| C、实验室制乙烯时应将无水乙醇缓慢加入浓硫酸中,并加入碎瓷片以防爆沸 |
| D、配制FeCl3溶液时,向试管中加入少量Fe和稀盐酸 |
如图装置或操作能达到相应实验目的是( )
| A | B | C | D |
 | 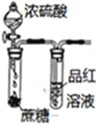 | 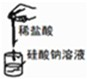 | 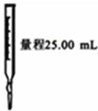 |
| 实验室利用氯化铵制取并收集NH3 | 说明浓H2SO4有脱水性、酸性、氧化性,SO2有漂白性 | 验证非金属性Cl>C>Si | 量取0.1mol?L-1KOH溶液20.00mL |
| A、A | B、B | C、C | D、D |
M3+有2个电子层,则M在元素周期表中的位置是( )
| A、第2周期0族 |
| B、第2周期Ⅷ族 |
| C、第3周期ⅢA族 |
| D、第3周期ⅡA族 |
 (g)
(g) (g)+3H2(g)
(g)+3H2(g)