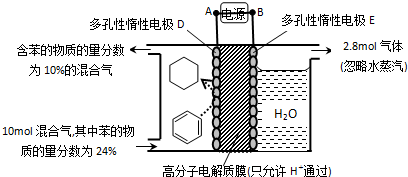
题目内容
1915年诺贝尔物理学奖授予Henry Bragg和Lawrence Bragg,以表彰他们用X射线对晶体结构的分析所作的贡献.
(一)科学家通过X射线探明,NaCl、KCl、MgO、CaO晶体结构相似,其中三种晶体的晶格能数据如下表:
四种晶体NaCl、KCl、MgO、CaO熔点由高到低的顺序是 > > > ,Na、Mg、Al第一电离能I从小到大的排列顺序是 > > .
(二)科学家通过X射线推测胆矾中既含有配位键,又含有氢键,其结构示意图可简单表示如图1,其中配位键和氢键均采用虚线表示.
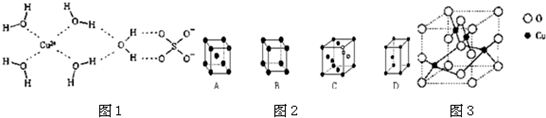
(1)请在如图1中标出配位键(用“→”表示配位键,并且“→”从配体指向中心体);金属铜采用如图2所示中的 (填字母代号)堆积方式.
(2)已知[Cu(NH3)4]2+具有对称的空间构型,[Cu(NH3)4]2+中的两个NH3被两个Cl-取代,能得到两种不同结构的产物,则[Cu(NH3)4]2+的空间构型为 .
(3)如图3是铜的某种氧化物的晶胞结构示意图,可确定该晶胞中阴离子的个数为 .
(4)SO42-的空间构型是 .
(一)科学家通过X射线探明,NaCl、KCl、MgO、CaO晶体结构相似,其中三种晶体的晶格能数据如下表:
| 晶体 | NaCl | KCl | CaO |
| 晶格能/(kJ?mol-1) | 786 | 715 | 3401 |
(二)科学家通过X射线推测胆矾中既含有配位键,又含有氢键,其结构示意图可简单表示如图1,其中配位键和氢键均采用虚线表示.

(1)请在如图1中标出配位键(用“→”表示配位键,并且“→”从配体指向中心体);金属铜采用如图2所示中的
(2)已知[Cu(NH3)4]2+具有对称的空间构型,[Cu(NH3)4]2+中的两个NH3被两个Cl-取代,能得到两种不同结构的产物,则[Cu(NH3)4]2+的空间构型为
(3)如图3是铜的某种氧化物的晶胞结构示意图,可确定该晶胞中阴离子的个数为
(4)SO42-的空间构型是
考点:晶体的类型与物质熔点、硬度、导电性等的关系,判断简单分子或离子的构型,晶胞的计算
专题:化学键与晶体结构
分析:(一)影响晶体晶格能大小的因素有离子半径以及离子所带电荷的多少,晶格能越大熔点越高;同一周期从左到右,第一电离能逐渐增大,第IIA族与第IIIA反常;
(二)(1)Cu2+提供空轨道,水中氧原子提供孤对电子;Cu为面心立方密堆积;
(2)形成4个配位键,具有对称的空间构型,可能为平面正方形或正四面体,如为正四面体,[Cu(NH3)4]2+中的两个NH3被两个Cl-取代,只有一种结构;
(3)利用均摊法分析晶胞的结构;
(4)计算S原子价层电子对数与孤对电子,判断SO42-的空间结构.
(二)(1)Cu2+提供空轨道,水中氧原子提供孤对电子;Cu为面心立方密堆积;
(2)形成4个配位键,具有对称的空间构型,可能为平面正方形或正四面体,如为正四面体,[Cu(NH3)4]2+中的两个NH3被两个Cl-取代,只有一种结构;
(3)利用均摊法分析晶胞的结构;
(4)计算S原子价层电子对数与孤对电子,判断SO42-的空间结构.
解答:
解:(1)离子半径Mg2+<Na+<O2-<Ca2+<Cl-;离子电荷数Na+=Cl-<O2-=Mg2+=Ca2+,离子晶体的离子半径越小,带电荷数越多,晶格能越大,则晶体的熔沸点越高,则有NaCl、KCl、MgO、CaO熔点由高到低的顺序是MgO>CaO>NaCl>KCl;同一周期从左到右,第一电离能逐渐增大,第IIA族与第IIIA反常,所以第一电离能:
Mg>Al>Na;
故答案为:MgO>CaO>NaCl>KCl;Mg;Al;Na;
(二)(1)Cu2+提供空轨道,水中氧原子提供孤对电子,形成配位键,水合铜离子的结构简式为: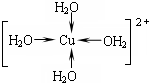 ;Cu为面心立方密堆积,配位数为12,故C符合;
;Cu为面心立方密堆积,配位数为12,故C符合;
故答案为: ;C;
;C;
(2)形成4个配位键,具有对称的空间构型,可能为平面正方形或正四面体,如为正四面体,[Cu(NH3)4]2+中的两个NH3被两个Cl-取代,只有一种结构,所以应为平面正方形,故答案为:平面正方形;
(3)从图中可以看出阴离子在晶胞有四类:顶点(8个)、棱上(4个)、面上(2个)、体心(1个),根据立方体的分摊法,可知该晶胞中阴离子数目为
×8+
×4+
×2+1=4,故答案为:4;
(4)SO42-中中心原子S的价层电子对数=4+
=4、孤电子对数为0,所以为正四面体结构,
故答案为:正四面体.
Mg>Al>Na;
故答案为:MgO>CaO>NaCl>KCl;Mg;Al;Na;
(二)(1)Cu2+提供空轨道,水中氧原子提供孤对电子,形成配位键,水合铜离子的结构简式为:
 ;Cu为面心立方密堆积,配位数为12,故C符合;
;Cu为面心立方密堆积,配位数为12,故C符合;故答案为:
 ;C;
;C;(2)形成4个配位键,具有对称的空间构型,可能为平面正方形或正四面体,如为正四面体,[Cu(NH3)4]2+中的两个NH3被两个Cl-取代,只有一种结构,所以应为平面正方形,故答案为:平面正方形;
(3)从图中可以看出阴离子在晶胞有四类:顶点(8个)、棱上(4个)、面上(2个)、体心(1个),根据立方体的分摊法,可知该晶胞中阴离子数目为
| 1 |
| 8 |
| 1 |
| 4 |
| 1 |
| 2 |
(4)SO42-中中心原子S的价层电子对数=4+
| 6+2-2×4 |
| 2 |
故答案为:正四面体.
点评:本题考查了离子晶体的熔点比较、第一电离能的比较、常见轨道杂化类型、以及离子晶体的晶胞结构、化学键、物质性质、配合物成键状况的了解,题目难度中等,学习中注意加强对晶胞以及晶体结构的分析.

练习册系列答案
相关题目
短周期主族元素X、Y、Z、W、Q的原子序数依次增大,X的气态氢化物极易溶于Y的氢化物中,常温下,Z的单质能溶于W的最高价氧化物的水化物的稀溶液,却不溶于其浓溶液.下列说法不正确的是( )
| A、离子半径的大小顺序为W>Q>Z>X>Y |
| B、元素X的气态氢化物与Q的单质可发生置换反应 |
| C、元素X与Y可以形成5种以上的化合物 |
| D、元素Z、W、Q的单质在一定条件下均能和强碱溶液反应 |
下列混合物的分离或提纯操作不正确的是( )
| A、除去N2中的少量O2,可通过灼热的Cu网后,收集气体 |
| B、除去FeCl3溶液中Fe(OH)3沉淀可以过滤 |
| C、重结晶不能用于提纯物质 |
| D、除去KCl中的K2CO3加适量盐酸 |
四联苯 的一氯代物有( )
的一氯代物有( )
 的一氯代物有( )
的一氯代物有( )| A、3种 | B、4种 | C、5种 | D、6种 |
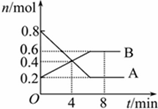 某温度时,在0.5L密闭容器中某一反应的A,B气体物质随时间变化的曲线如图所示,由图中数据分析求得:
某温度时,在0.5L密闭容器中某一反应的A,B气体物质随时间变化的曲线如图所示,由图中数据分析求得: 向一容积不变的密闭容器中充入一定量A和B,发生如下反应:x A(g)+2B(s)?y C(g);△H<0
向一容积不变的密闭容器中充入一定量A和B,发生如下反应:x A(g)+2B(s)?y C(g);△H<0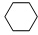 (g)
(g)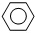 (g)+3H2(g)
(g)+3H2(g)