题目内容
10.某溶液可能含有Cl-、SO42-、NH4+、Fe3+、Al3+和K+.取该溶液100mL,加入过量NaOH 溶液,加热,得到0.02mol 气体,同时产生红褐色沉淀;过滤,洗涤,灼烧,得到 1.6g 固体;向上述滤液中加足量BaCl2溶液,得到 4.66g 不溶于盐酸的沉淀.由此可知原溶液中( )| A. | 至少存在5 种离子 | |
| B. | SO42-、NH4+、Fe3+、一定存在,Cl-、K+、Al3+可能存在 | |
| C. | K+一定存在,Al3+可能存在 | |
| D. | Cl-一定存在,且c(Cl-)≥0.4mol/L |
分析 加入过量NaOH溶液,加热,得到0.02mol气体,可知一定存在铵根离子,红褐色沉淀是氢氧化铁,1.6g固体为三氧化二铁,可知一定有Fe3+,
4.66g不溶于盐酸的沉淀,为硫酸钡沉淀,物质的量=$\frac{4.66g}{233g/mol}$=0.02mol,根据以上数据推算存在离子,根据电荷守恒推算氯离子的存在及数据.
解答 解:加入过量NaOH溶液,加热,得到0.02mol气体,可知一定存在铵根离子,红褐色沉淀是氢氧化铁,1.6g固体为三氧化二铁,可知一定有Fe3+,4.66g不溶于盐酸的沉淀,为硫酸钡沉淀,物质的量=$\frac{4.66g}{233g/mol}$=0.02mol,
A.由上述分析可知,一定含SO42-、NH4+、Fe3+,溶液中NH4+、Fe3+所带正电荷为0.02mol+3×0.02mol=0.08mol,SO42-所带负电荷为2×0.02mol=0.04mol,据电荷守恒,知溶液中必然大量存在另一种阴离子Cl-,至少存在4种离子,故A错误;
B.由上述分析可知,SO42-、NH4+、Fe3+一定存在,由电荷守恒可知,Cl-一定存在,故B错误;
C.由上述分析可知,SO42-、NH4+、Fe3+、Cl-一定存在,可能含Al3+、K+,故C错误;
D.综上所述,原溶液中一定含Fe3+、NH4+、SO42-和Cl-,由电荷守恒可知,Cl-一定存在,且c(Cl-)≥$\frac{0.08mol-0.04mol}{0.1L}$=0.4mol/L,可能含Al3+、K+,故D正确;
故选D.
点评 本题考查物质的检验及推断,为高考常见题型和高频考点,侧重于元素化合物知识的综合理解和运用的考查,注意常见离子的性质和反应类型的判断,答题时认真阅读、分析题中数据,合理分析,特别是氯离子的推断,题目难度中等.

 名校课堂系列答案
名校课堂系列答案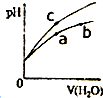
| A. | b、c三点溶液的离子浓度之和c>b>a | |
| B. | b点溶液中c(H+)+c(NH3•H2O)=(OH-) | |
| C. | 用等浓度的NaOH溶液和等体积b、c处溶液反应,恰好反应时消耗NaOH溶液的体积Vb=Vc | |
| D. | a、b、c三点溶液中水的电离程度a>b>c |
| A. | Fe2O3与HCl反应 | B. | 过量铁粉与稀硝酸反应 | ||
| C. | 少量铁粉与稀盐酸作用 | D. | 铁粉与CuSO4反应 |
(1)纳米技术制成的金属燃料、非金属固体燃料、氢气等已应用到社会生活和高科技领域.单位质量的A和B单质燃烧时均放出大量热,可用作燃料.已知A和B为短周期元素,其原子的第一至第四电离能如下表所示:
| 电离能(kJ/mol) | I1 | I2 | I3 | I4 |
| A | 932 | 1821 | 15399 | 21771 |
| B | 738 | 1451 | 7733 | 10540 |

②ACl2分子中A的杂化类型为sp杂化,ACl2的空间构型为直线形.
(2)Fe原子或离子外围有较多能量相近的空轨道能与一些分子或离子形成配合物.
①以体心立方堆积形成的金属铁中,其原子的配位数为8.
②写出一种与CN-互为等电子体的单质的电子式
 .
.③六氰合亚铁离子[Fe(CN)6]4-中不存在B.
A.共价键 B.非极性键 C.配位键 D.σ键 E.π键
(3)一种Al-Fe合金的立体晶胞如图2所示.请据此回答下列问题:
①确定该合金的化学式Fe2Al.
②若晶体的密度=ρ g/cm3,则此合金中最近的两个Fe原子之间的距离(用含ρ的代数式表示,不必化简)为$\root{3}{\frac{139}{2ρ{N}_{A}}}$cm.
| A. | C2H6 | B. | C3H6 | C. | C4H8 | D. | C5H10 |
| A. | 在水溶液中或熔融状态下能导电的化合物是电解质 | |
| B. | 三氧化硫溶于水后,溶液能导电,三氧化硫是电解质 | |
| C. | 硝酸钾在电流作用下电离出钾离子和硝酸根离子 | |
| D. | 溶于水后能电离出氢离子的化合物都是酸 |
| A. | 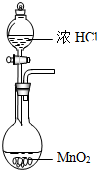 实验室用如图装置制备Cl2 | B. |  加热如图中溶液,溶液变为红色 | ||
| C. |  如图装置可除去Cl2中少量HCl | D. | 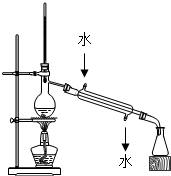 用如图装置制取蒸馏水 |
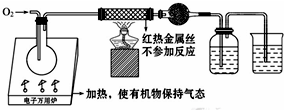 一名同学把4.48L(已折算成标准状况下)某有机物蒸气在O2中充分燃烧,然后让产物依次通过装有无水CuSO4的干燥管、盛有浓H2SO4的洗气瓶和盛有含0.8mol Ca(OH)2的澄清石灰水的烧杯,如图所示:
一名同学把4.48L(已折算成标准状况下)某有机物蒸气在O2中充分燃烧,然后让产物依次通过装有无水CuSO4的干燥管、盛有浓H2SO4的洗气瓶和盛有含0.8mol Ca(OH)2的澄清石灰水的烧杯,如图所示: .
.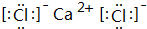 ;
; .
.