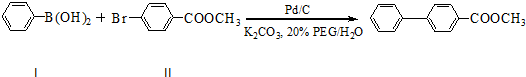题目内容
如图I是实验室用氢气还原氧化铜实验的简易装置,其中的铜质燃烧匙可以在试管M中上下移动,虚线框中需从图Ⅱ中选取装置.图Ⅱ中的细铜丝一端被弯成螺旋状,先在酒精灯火焰上加热,变黑后再迅速伸人制得的氢气中

(1)在图I中,试管M中的液体应选用 ;
(2)在图I的虚线框中,应选用图Ⅱ中的 (填“A”或“B”)装置;
(3)上述制氧气的方法与将锌粒直接加人试管中相比,其优点主要是 .

(1)在图I中,试管M中的液体应选用
(2)在图I的虚线框中,应选用图Ⅱ中的
(3)上述制氧气的方法与将锌粒直接加人试管中相比,其优点主要是
考点:性质实验方案的设计,铜金属及其重要化合物的主要性质
专题:实验题
分析:(1)制取氢气最为适宜的药品是锌粒和稀硫酸或稀盐酸;
(2)根据氢气的密度小于空气的密度选择装置;
(3)根据铜制燃烧匙和锌在稀硫酸中 形成原电池加快反应速率,可以在试管M中上下移动,控制反应速率分析解答.
(2)根据氢气的密度小于空气的密度选择装置;
(3)根据铜制燃烧匙和锌在稀硫酸中 形成原电池加快反应速率,可以在试管M中上下移动,控制反应速率分析解答.
解答:
解:(1)氢气的实验室制法中,最好的药品选择就是锌粒与稀硫酸或稀盐酸,因为反应速率适中易于控制,而且不会影响氢气的纯度,
故答案为:稀硫酸或稀盐酸;
(2)因为氢气的密度比空气小,所以选B装置才能收集氢气并且完成氢气与氧化铜的反应,
故答案为:B;
(3)根据题目信息燃烧匙可以在试管M中上下移动,当燃烧匙脱离稀硫酸的液面时,反应物分离,反应停止.需要反应进行时可再将燃烧匙插入液面以下,由于铜与锌构成原电池,故生成氢气的速度快;可通过铜质燃烧匙的上下移动来直接控制反应的进行或停止,
故答案为:由于铜与锌构成原电池,故生成氢气的速度快;可通过铜质燃烧匙的上下移动来直接控制反应的进行或停止.
故答案为:稀硫酸或稀盐酸;
(2)因为氢气的密度比空气小,所以选B装置才能收集氢气并且完成氢气与氧化铜的反应,
故答案为:B;
(3)根据题目信息燃烧匙可以在试管M中上下移动,当燃烧匙脱离稀硫酸的液面时,反应物分离,反应停止.需要反应进行时可再将燃烧匙插入液面以下,由于铜与锌构成原电池,故生成氢气的速度快;可通过铜质燃烧匙的上下移动来直接控制反应的进行或停止,
故答案为:由于铜与锌构成原电池,故生成氢气的速度快;可通过铜质燃烧匙的上下移动来直接控制反应的进行或停止.
点评:本题考查了氢气的实验室制法、物理性质(密度)和化学性质(还原性)以及对实验设计的评价,注重了基础知识的考查.

练习册系列答案
相关题目
标准状况下,11.2g某气体的分子数与22gCO2的分子数相等,则该气体的密度是( )
| A、1g/L | B、1.5g/L |
| C、2g/L | D、3g/L |
下列反应的离子方程式书写正确的是( )
| A、澄清石灰水与过量小苏打溶液混合:Ca2++OH-+HCO3-═CaCO3↓+H2O |
| B、碳酸钙溶于醋酸:CaCO3+2H+=Ca2++CO2↑+H2O |
| C、盛装氢氧化钠溶液的试剂瓶不可以用玻璃塞:SiO2+2Na++2 OH-=Na2SiO3+H2O |
| D、向NH4HSO4稀溶液中逐滴加入Ba(OH)2稀溶液至刚好沉淀完全:Ba2++2OH-+NH4++H++SO42-=BaSO4↓+NH3?H2O+H2O |
下列各溶液中,微粒的物质的量浓度关系正确的是( )
| A、常温下,将pH=2的盐酸和pH=12的氨水等体积混合:c(NH4+)>c(Cl-)>c(OH-)>c(H+) |
| B、0.1mol?L-1 Na2CO3溶液:c(Na+)=c(HCO3-)+2c(CO32-)+2c(H2CO3) |
| C、0.1mol?L-1 NH4Cl溶液:c(NH4+)=c( Cl-) |
| D、向醋酸钠溶液加适量醋酸,得到的混合溶液:c(Na+)+c(H+)=c(CH3COO-)+c(OH-) |
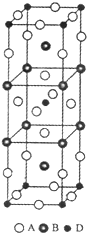 前四周期原子序数依次增大的元素A、B、C、D中,A和B的价电子层中未成对电子均只有1个,并且A-和B+的电子总数相差为8;与B位于同一周期的C和D,它们的价电子层排布中未成对电子数分别为4和2,且原子序数相差为2.
前四周期原子序数依次增大的元素A、B、C、D中,A和B的价电子层中未成对电子均只有1个,并且A-和B+的电子总数相差为8;与B位于同一周期的C和D,它们的价电子层排布中未成对电子数分别为4和2,且原子序数相差为2. CuCl是应用广泛的有机合成催化剂,也在染料工业中用作实效型气体吸收剂.利用废旧印刷电路板制氯化亚铜可减少污染、实现资源再生.请回答下列问题:
CuCl是应用广泛的有机合成催化剂,也在染料工业中用作实效型气体吸收剂.利用废旧印刷电路板制氯化亚铜可减少污染、实现资源再生.请回答下列问题: