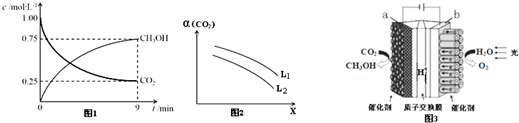
题目内容
7. 现在污水治理越来越引起人们重视,可以通过膜电池除去废水中的乙酸钠和对氯苯酚,其原理如图所示,下列说法正确的是( )
现在污水治理越来越引起人们重视,可以通过膜电池除去废水中的乙酸钠和对氯苯酚,其原理如图所示,下列说法正确的是( )| A. | 电流方向从B极沿导线经小灯泡流向A极 | |
| B. | A极的电极反应式为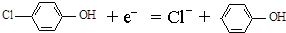 | |
| C. | 当外电路中有0.2mole-转移时,通过质子交换膜的H+的个数为0.2NA | |
| D. | B极为电池的正极,发生还原反应 |
分析 原电池中阳离子移向正极,根据原电池中氢离子的移动方向可知A为正极,正极有氢离子参与反应,电极反应式为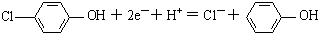 ,电流从正极经导线流向负极,据此分析.
,电流从正极经导线流向负极,据此分析.
解答 解:A、电流从正极A沿导线流向负极B,故A错误;
B、A为正极,正极有氢离子参与反应,电极反应式为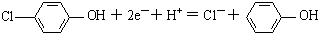 ,故B错误;
,故B错误;
C、据电荷守恒,当外电路中有0.2mole-转移时,通过质子交换膜的H+的个数为0.2NA,故C正确;
D、B为原电池负极,发生氧化反应,故D错误;
故选C.
点评 本题涉及电解池的工作原理以及应用的考查,注意知识的迁移和应用是解题的关键,难度中等.

练习册系列答案
 计算高手系列答案
计算高手系列答案
相关题目
15.晶体是一类非常重要的材料,在很多领域都有广泛的应用.我国现已能够拉制出直径为300毫米,重量达81千克的大直径硅单晶,晶体硅大量用于电子产业.下列对晶体硅的叙述正确的是( )
| A. | 晶体硅没有固定的熔沸点 | |
| B. | 形成晶体硅的速率越快越好 | |
| C. | 可用于X-射线衍射实验来鉴别晶体硅和玻璃 | |
| D. | 晶体硅的形成与晶体的自范性有关,形成的晶体无各向异性 |
12.分子式为C5H10O2的有机物X,在酸性条件能够发生水解反应生成相对分子质量相等的两种有机物,符合条件的有机物X有( )
| A. | 2种 | B. | 4种 | C. | 9种 | D. | 13种 |
17.CH2CH2Br与NH3反应生成(CH2CH2)2NH和HBr,下列说法错误的是( )
| A. | 若原料完全反应生成上述产物,CH2CH2Br与NH3的物质之比为2:1 | |
| B. | 该反应属于取代反应 | |
| C. | CH2CH2Br与HBr均属于电解质 | |
| D. | CH2CH2Br难溶于水 |
 CuSO4在活化闪锌矿(主要成分是ZnS)方面有重要作用,主要是活化过程中生成CuS、Cu2S等一系列铜的硫化物活化组分.
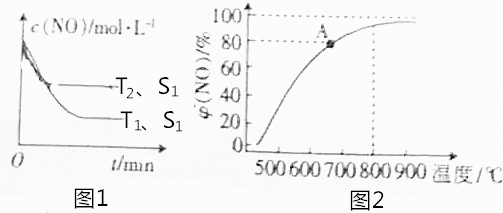
CuSO4在活化闪锌矿(主要成分是ZnS)方面有重要作用,主要是活化过程中生成CuS、Cu2S等一系列铜的硫化物活化组分. ;
;
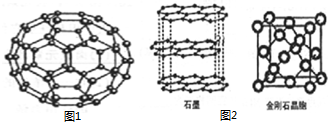 C60(结构模型如图1所示)的发现是化学界的大事之一.C60与金属钾化合生成K3C60具有超导性.
C60(结构模型如图1所示)的发现是化学界的大事之一.C60与金属钾化合生成K3C60具有超导性.

 .
. ,F
,F ;
;