题目内容
17.CH2CH2Br与NH3反应生成(CH2CH2)2NH和HBr,下列说法错误的是( )| A. | 若原料完全反应生成上述产物,CH2CH2Br与NH3的物质之比为2:1 | |
| B. | 该反应属于取代反应 | |
| C. | CH2CH2Br与HBr均属于电解质 | |
| D. | CH2CH2Br难溶于水 |
分析 CH3CH2Br与NH3反应生成(CH3CH2)2NH和HBr,方程式为:2CH3CH2Br+NH3→2(CH3CH2)2NH+2HBr,CH3CH2Br中的溴原子被氢原子取代,卤代烃难溶于水,无法电离出溴离子,属于非电解质;
解答 解:A.2CH3CH2Br+NH3→2(CH3CH2)2NH+2HBr,CH3CH2Br与NH3的物质的量之比为2:1,故A正确;
B.CH3CH2Br中的溴原子被氢原子取代,属于取代反应,故B正确;
C.CH3CH2Br属于非电解质,HBr属于电解质,故C错误;
D.CH3CH2Br难溶于水,故D正确,
故选C.
点评 本题以化学反应考查有机物的性质、有机反应类型,题目较为简单,注意理解常见有机反应类型,注意取代反应与其它反应类型的区别.

练习册系列答案
相关题目
7.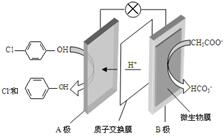 现在污水治理越来越引起人们重视,可以通过膜电池除去废水中的乙酸钠和对氯苯酚,其原理如图所示,下列说法正确的是( )
现在污水治理越来越引起人们重视,可以通过膜电池除去废水中的乙酸钠和对氯苯酚,其原理如图所示,下列说法正确的是( )
 现在污水治理越来越引起人们重视,可以通过膜电池除去废水中的乙酸钠和对氯苯酚,其原理如图所示,下列说法正确的是( )
现在污水治理越来越引起人们重视,可以通过膜电池除去废水中的乙酸钠和对氯苯酚,其原理如图所示,下列说法正确的是( )| A. | 电流方向从B极沿导线经小灯泡流向A极 | |
| B. | A极的电极反应式为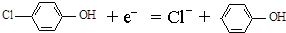 | |
| C. | 当外电路中有0.2mole-转移时,通过质子交换膜的H+的个数为0.2NA | |
| D. | B极为电池的正极,发生还原反应 |
5.饱和二氧化硫水溶液中存在下列平衡体系:
SO2+H2O?H++HSO3-
HSO3-?H++SO3-
若向此溶液中( )
SO2+H2O?H++HSO3-
HSO3-?H++SO3-
若向此溶液中( )
| A. | 加水,SO3-浓度增大 | |
| B. | 通入少量Cl2气体,溶液pH增大 | |
| C. | 加少量CaSO3粉末,HSO3-浓度基本不变 | |
| D. | 通入少量HCl气体,溶液中HSO3-浓度减小 |
12. 如图是某同学研究铜与浓硫酸的反应装置:
如图是某同学研究铜与浓硫酸的反应装置:
完成下列填空:
(1)写出A中发生反应的化学方程式Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+2H2O+SO2↑.
采用可抽动铜丝进行实验的优点是可以控制反应的进行.
(2)反应一段时间后,可观察到B试管中的现象为变红.
(3)从C试管的直立导管中向BaCl2溶液中通入另一种气体,产生白色沉淀,则气体可以是NH3、
Cl2.(要求填一种化合物和一种单质的化学式)
(4)反应完毕,将A中的混合物倒入水中,得到呈酸性的蓝色溶液与少量黑色不溶物,分离出该不溶物的操作是过滤.该黑色不溶物不可能是CuO,理由是CuO会溶于稀硫酸中.
(5)对铜与浓硫酸反应产生的黑色不溶物进行探究,实验装置及现象如下:
①根据实验现象可判断黑色不溶物中一定含有硫元素.
②若该黑色不溶物由两种元素组成且在反应前后质量保持不变,推测其化学式为Cu2S.
 如图是某同学研究铜与浓硫酸的反应装置:
如图是某同学研究铜与浓硫酸的反应装置:完成下列填空:
(1)写出A中发生反应的化学方程式Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+2H2O+SO2↑.
采用可抽动铜丝进行实验的优点是可以控制反应的进行.
(2)反应一段时间后,可观察到B试管中的现象为变红.
(3)从C试管的直立导管中向BaCl2溶液中通入另一种气体,产生白色沉淀,则气体可以是NH3、
Cl2.(要求填一种化合物和一种单质的化学式)
(4)反应完毕,将A中的混合物倒入水中,得到呈酸性的蓝色溶液与少量黑色不溶物,分离出该不溶物的操作是过滤.该黑色不溶物不可能是CuO,理由是CuO会溶于稀硫酸中.
(5)对铜与浓硫酸反应产生的黑色不溶物进行探究,实验装置及现象如下:
| 实验装置 | 实验现象 |
 | 品红褪色 |
②若该黑色不溶物由两种元素组成且在反应前后质量保持不变,推测其化学式为Cu2S.
9.下列操作不正确的是( )
| A. | 配制氯化铁溶液时需加入少量盐酸 | |
| B. | 金属钠保存在装有煤油的带玻璃塞的广口瓶中 | |
| C. | 保存液溴需用水封,放在带橡皮塞子的棕色细口瓶中 | |
| D. | 用稀硝酸洗去附在试管内壁的银镜 |
6.由分类思想,下列说法正确的是( )
| A. | 氢氧化钠、盐酸都为强电解质 | |
| B. | 铁生锈、食物腐败都有氧化反应发生 | |
| C. | 糖类、蛋白质都为高分子化合物 | |
| D. | 一氯甲烷、二氧化碳都是极性分子 |
7.下列有关实验原理、操作及安全知识的叙述,正确的是( )
| A. | 不慎将苯酚固体粉末沾在皮肤上,立即用大量热水(>65℃)冲洗 | |
| B. | 银氨溶液、Cu(OH)2悬浊液、氯水在实验室里均不宜长期放置 | |
| C. | 检验C2H5Cl中的氯元素:将C2H5Cl与NaOH溶液混合加热,冷却后加AgNO3溶液 | |
| D. | 同温下用pH试纸测定等浓度的NaClO溶液和CH3COONa溶液的pH,可以证明HClO和CH3COOH的酸性强弱 |

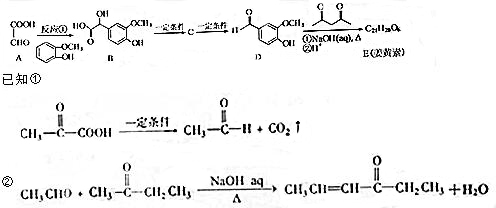
 .
.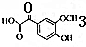 .
.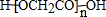 .
. ,下列有关E的叙述正确的是ac.
,下列有关E的叙述正确的是ac.