题目内容
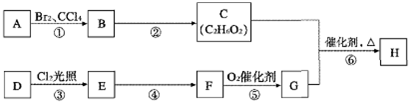
从固体混合物A出发可以发生如图甲所示的一系列变化:

(1)在实验室中常用反应①制取气体C.若要收集气体C,可选择图乙装置中的 (填字母)

(2)操作②的名称是 ,在操作②中所使用的玻璃仪器的名称是 .
(3)写出下列反应的方程式:
反应①的化学方程式
反应③的化学方程式
(4)在实验室中,要获得干燥纯净的黄绿色气体F,可以将它通过图丙中的装置,其中瓶Ⅰ中盛放的是 ,瓶Ⅱ中盛放的是 .
(5)实验中必须吸收多余的气体,以免污染空气.图丁是实验室NaOH溶液吸收气体F的装置,为防止发生倒吸现象,合理的装置是 (填选项字母)


(1)在实验室中常用反应①制取气体C.若要收集气体C,可选择图乙装置中的

(2)操作②的名称是
(3)写出下列反应的方程式:
反应①的化学方程式
反应③的化学方程式
(4)在实验室中,要获得干燥纯净的黄绿色气体F,可以将它通过图丙中的装置,其中瓶Ⅰ中盛放的是
(5)实验中必须吸收多余的气体,以免污染空气.图丁是实验室NaOH溶液吸收气体F的装置,为防止发生倒吸现象,合理的装置是

考点:无机物的推断,物质分离、提纯的实验方案设计
专题:实验设计题
分析:F为黄绿色气体,则F为Cl2,反应④为二氧化锰与浓盐酸的反应,则D为MnO2,I为MnCl2,G为不溶于稀硝酸的白色固体;溶液H的焰色反应呈紫色,则G为AgCl,H为KNO3,E为KCl,混合物B为MnO2、KCl的混合物,则反应①为2KClO3
2KCl+3O2↑,A为KClO3、MnO2的混合物,气体C为O2,以此来解答.
| ||
| △ |
解答:
解:F为黄绿色气体,则F为Cl2,反应④为二氧化锰与浓盐酸的反应,则D为MnO2,I为MnCl2,G为不溶于稀硝酸的白色固体;溶液H的焰色反应呈紫色,则G为AgCl,H为KNO3,E为KCl,混合物B为MnO2、KCl的混合物,则反应①为2KClO3
2KCl+3O2↑,A为KClO3、MnO2的混合物,气体C为O2,
(1)氧气不溶于水,可选A用排水法收集,氧气的密度比空气的大,可选B用向上排空气法收集,故答案为:AB;
(2)B为MnO2、KCl的混合物,KCl溶于水,而MnO2不溶于水,可利用过滤来分离,过滤操作使用的玻璃仪器为漏斗、玻璃棒、烧杯,
故答案为:过滤;漏斗、玻璃棒、烧杯;
(3)反应①的化学方程式为2KClO3
2KCl+3O2↑,反应④的离子反应为MnO2+2Cl-+4H+═Mn2++Cl2↑+2H2O,
故答案为:2KClO3
2KCl+3O2↑;MnO2+2Cl-+4H+═Mn2++Cl2↑+2H2O;
(4)要获得干燥纯净的黄绿色气体氯气,瓶Ⅰ中盛放饱和食盐水抑制氯气的溶解同时除去混有的HCl,在瓶Ⅱ中盛放浓H2SO4干燥即可,故答案为:饱和食盐水;浓H2SO4;
(5)用NaOH溶液吸收气体氯气的装置,为防止产生倒吸现象,装置中有倒扣的漏斗或肚容式结构,a装置中进气导管过长不具有防倒吸的作用,cd中漏斗、球泡均在液面下不能防止倒吸,只有b符合,故答案为:b.
| ||
| △ |
(1)氧气不溶于水,可选A用排水法收集,氧气的密度比空气的大,可选B用向上排空气法收集,故答案为:AB;
(2)B为MnO2、KCl的混合物,KCl溶于水,而MnO2不溶于水,可利用过滤来分离,过滤操作使用的玻璃仪器为漏斗、玻璃棒、烧杯,
故答案为:过滤;漏斗、玻璃棒、烧杯;
(3)反应①的化学方程式为2KClO3
| ||
| △ |
故答案为:2KClO3
| ||
| △ |
(4)要获得干燥纯净的黄绿色气体氯气,瓶Ⅰ中盛放饱和食盐水抑制氯气的溶解同时除去混有的HCl,在瓶Ⅱ中盛放浓H2SO4干燥即可,故答案为:饱和食盐水;浓H2SO4;
(5)用NaOH溶液吸收气体氯气的装置,为防止产生倒吸现象,装置中有倒扣的漏斗或肚容式结构,a装置中进气导管过长不具有防倒吸的作用,cd中漏斗、球泡均在液面下不能防止倒吸,只有b符合,故答案为:b.
点评:本题考查无机物的推断,利用物质的性质及发生的反应推断出各物质是解答本题的关键,(5)为解答的难点,题目难度不大,熟悉氧气的制法、氯气的制法及氯气的性质即可解答.

练习册系列答案
相关题目
某强酸性溶液中可能存在NO3-、I-、Cl-、Fe3+中的一种或几种.向该溶液中加入溴水后,溴被还原,由此推断该溶液中( )
| A、不含NO3-,也不含Fe3+ |
| B、含有NO3-、I-、Cl? |
| C、含I-,且肯定含有Cl- |
| D、可能含有Fe3+ |
在蒸馏实验中,下列叙述不正确的是( )
A、在蒸馏烧瓶中盛约
| ||
| B、收集蒸馏水时,应弃去开始馏出的部分 | ||
| C、冷水从冷凝管下口入,上口出 | ||
| D、将温度计水银球插入自来水中 |
足量铜与一定量浓硝酸反应,得到硝酸铜溶液和NO2、N2O4、NO的混合气体,这些气体与1.68L O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸.若向所得硝酸铜溶液中加入6mol?L-1 NaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是( )
| A、60 mL |
| B、45 mL |
| C、30 mL |
| D、50 mL |
下列叙述正确的是( )
| A、强电解质一定易溶于水,弱电解质都难溶于水 |
| B、NaHCO3的热稳定性和溶解度均大于Na2CO3 |
| C、过量的铜与浓硝酸反应有一氧化氮生成 |
| D、Fe与S混合加热生成FeS2 |

 某兴趣小组的同学用如图所示装置研究有关电化学的问题.当闭合该装置的电键时,观察到电流表的指针发生了偏转.
某兴趣小组的同学用如图所示装置研究有关电化学的问题.当闭合该装置的电键时,观察到电流表的指针发生了偏转.