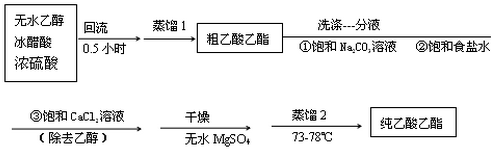
题目内容
15.现有如下两个反应:(A)NaOH+HCl═NaCl+H2O
(B)2FeCl3+Fe═3FeCl2
①根据两反应本质,分别判断能否用于设计原电池(A)不行(B)可以.
②如果不能,说明其原因(A)不是氧化还原反应,没有发生电子的转移.
分析 ①原电池反应是自发进行的放热的氧化还原反应,结合元素的化合价变化分析;
②原电池反应是自发进行的放热的氧化还原反应.
解答 解:①原电池反应是自发进行的放热的氧化还原反应,(A)中各元素化合价不变,不属于氧化还原反应,所以不能设计成原电池,(B)中Fe元素化合价发生变化,所以可以设计成原电池,
故答案为:(A)不行(B)可以;
②(A)不是氧化还原反应,没有发生电子的转移,所以不能设计成原电池,
故答案为:(A)不是氧化还原反应,没有发生电子的转移.
点评 本题考查原电池设计,侧重考查学生知识运用能力及实验方案设计能力,明确原电池原理是解本题关键,题目难度不大.

练习册系列答案
相关题目
3.下列各组反应(表中物质均为反应物),反应刚开始时,放出H2的速率最大的是( )
| 金属(粉末状)/mol | 酸的浓度及体积 | 反应温度 | |||
| A | Mg | 0.1 | 6mol/L盐酸 | 10mL | 30℃ |
| B | Mg | 0.1 | 3mol/L盐酸 | 10mL | 60℃ |
| C | Fe | 0.1 | 3mol/L盐酸 | 10mL | 60℃ |
| D | Mg | 0.1 | 6mol/L盐酸 | 10mL | 60℃ |
| A. | A | B. | B | C. | C | D. | D |
20.表是元素周期表的一部分,请用元素符号或者相关化学式回答有关问题:
(1)表中能形成两性氢氧化物的元素在周期表中的位置是第三周期第ⅢA;
(2)写出②的气态氢化物的结构式 ;
;
(3)元素④⑤⑥⑦离子半径由大到小的顺序S2->Cl->Mg2+>Al3+;
(4)①、⑥、⑦三种元素的最高价氧化物的水化物中酸性最强的是HClO4;
(5)⑥和⑦阴离子还原性较强的是S2-用一个置换反应证实这一结论(写化学方程式)Cl2+S2-=S+2Cl-;
(6)④⑤两元素相比较,金属性较强的是Mg,可以验证该结论的实验是bc;
(a)将在空气中放置已久的这两种元素的块状单质分别放入热水中
(b)将形状、大小相同的这两种元素的单质用砂纸打磨后分别和同浓度的盐酸反应
(c)将形状、大小相同两种元素的单质用砂纸打磨后分别和热水作用,并滴入酚酞
(d)比较这两种元素的气态氢化物的稳定性
(7)设计实验比较⑦⑩的非金属性强弱(实验药品:KBr溶液、KCl溶液、氯水、溴水,简述实验操作及现象向KBr溶液中滴加氯水,溶液变黄色,写出相关的离子方程式Cl2+2Br-=Br2+2Cl-.
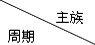 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
(2)写出②的气态氢化物的结构式
 ;
;(3)元素④⑤⑥⑦离子半径由大到小的顺序S2->Cl->Mg2+>Al3+;
(4)①、⑥、⑦三种元素的最高价氧化物的水化物中酸性最强的是HClO4;
(5)⑥和⑦阴离子还原性较强的是S2-用一个置换反应证实这一结论(写化学方程式)Cl2+S2-=S+2Cl-;
(6)④⑤两元素相比较,金属性较强的是Mg,可以验证该结论的实验是bc;
(a)将在空气中放置已久的这两种元素的块状单质分别放入热水中
(b)将形状、大小相同的这两种元素的单质用砂纸打磨后分别和同浓度的盐酸反应
(c)将形状、大小相同两种元素的单质用砂纸打磨后分别和热水作用,并滴入酚酞
(d)比较这两种元素的气态氢化物的稳定性
(7)设计实验比较⑦⑩的非金属性强弱(实验药品:KBr溶液、KCl溶液、氯水、溴水,简述实验操作及现象向KBr溶液中滴加氯水,溶液变黄色,写出相关的离子方程式Cl2+2Br-=Br2+2Cl-.
4.下列各组物质属于同系物的是( )
| A. | 2,2-二甲基丙烷和新戊烷 | |
| B. | 2,2-二甲基-1-丙醇和2-甲基-1-丁醇 | |
| C. | 对氯甲苯和邻氯乙苯 | |
| D. | 甲基丙烯酸和甲酸丁酯 |
5.下表是元素周期表的一部分,针对表中元素,填写下列空白.
(1)写出Na+结构示意图 ,氯元素的原子结构示意图
,氯元素的原子结构示意图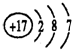 ;
;
(2)F、Cl、S的氢化物中稳定性最强的是HF(填氢化物名称);
(3)表中氧化性最强的单质的化学式为F2;
(4)这些元素的最高价氧化物的水化物中,碱性最强的是NaOH(填化学式);
(5)氧和钠两种元素中,离子半径较小的是Na+(填离子符号);
(6)氧,硫,磷三种元素的气态氢化物的稳定性强弱顺序为H2O>H2S>PH3(填化学式);
(7)碳与氧形成的化合物中,固态时俗称干冰的电子式 ,该化合物属于共价(填“共价”或“离子”)化合物.
,该化合物属于共价(填“共价”或“离子”)化合物.
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 2 | Li | Be | B | C | N | O | F |
| 3 | Na | Mg | Al | Si | P | S | Cl |
 ,氯元素的原子结构示意图
,氯元素的原子结构示意图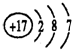 ;
;(2)F、Cl、S的氢化物中稳定性最强的是HF(填氢化物名称);
(3)表中氧化性最强的单质的化学式为F2;
(4)这些元素的最高价氧化物的水化物中,碱性最强的是NaOH(填化学式);
(5)氧和钠两种元素中,离子半径较小的是Na+(填离子符号);
(6)氧,硫,磷三种元素的气态氢化物的稳定性强弱顺序为H2O>H2S>PH3(填化学式);
(7)碳与氧形成的化合物中,固态时俗称干冰的电子式
 ,该化合物属于共价(填“共价”或“离子”)化合物.
,该化合物属于共价(填“共价”或“离子”)化合物.