题目内容
7.请指出下列影响化学反应速率的因素A.浓度 B.催化剂 C.固体表面积 D.温度 E.反应物本身的性质
(1)食物保存在冰箱里D
(2)H2O2分解时加少量的MnO2B
(3)大小相同是Mg与Al分别投入到相同浓度的盐酸中,Mg反应较快E
(4)相同大小的锌片在3mol/L的H2SO4中比在1mol/L的H2SO4中反应快A
(5)铁粉比铁片在同浓度的盐酸中反应快C.
分析 根据温度、浓度、催化剂、接触面积对反应速率的影响可知,降低温度,反应速率减慢,而增大接触面、使用催化剂、增大浓度加快反应速率.
解答 解:(1)食物保存在冰箱里是通过降低温度达到减慢失误腐败变质的反应速率的目的,故选D;
(2)H2O2分解时,少量的MnO2起到催化剂的作用,可以加快水分解的速率,故选B;
(3)大小相同是Mg与Al分别投入到相同浓度的盐酸中,Mg反应较快,是因为金属Mg的活泼性强于金属铝,即内因决定的,故选E;
(4)相同大小的锌片在3mol/L的H2SO4中比在1mol/L的H2SO4中反应快,是因为硫酸的浓度越大,反应速率越快,故选A;
(5)铁粉比铁片在同浓度的盐酸中反应快,是因为铁粉的表面积大于铁片,故选C.
点评 本题考查影响反应速率的因素,熟悉温度、浓度、催化剂、接触面积对反应速率的影响即可解答,题目难度不大.

练习册系列答案
 综合自测系列答案
综合自测系列答案
相关题目
17.下表列出了A-H八种短周期元素的原子半径和主要化合价.
已知B、E、F与C同周期,回答下列问题:
(1)G在元素周期表中的位置是第三周期VIA族(填周期和族)
(2)上述八种元素中,最高价氧化物的水化物酸性最强的是HClO4(填化学式),气态氢化物水溶液pH>7的是NH3(填化学式);
(3)B、D、E、F四种元素的离子,其离子半径最大的是O2-(填离子符号);
(4)A2D的电子式是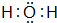 ,B、H两种元素形成化合物的电子式是
,B、H两种元素形成化合物的电子式是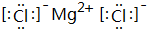 ;
;
(5)A、C、H三种元素组成的化合物的化学式是NH4Cl,该化合物属于离子化合物(填“离子”或“共价”);
(6)E、F两种元素的最高价氧化物的水化物发生反应的离子方程式是Al(OH)3+OH-=AlO2-+2H2O.
| 元素代号 | A | B | C | D | E | F | G | H |
| 原子半径/pm | 37 | 160 | 70 | 66 | 186 | 143 | 104 | 99 |
| 最高化合价 | +1 | +2 | +5 | +1 | +3 | +6 | +7 | |
| 最低化合价 | -3 | -2 | -2 | -1 |
(1)G在元素周期表中的位置是第三周期VIA族(填周期和族)
(2)上述八种元素中,最高价氧化物的水化物酸性最强的是HClO4(填化学式),气态氢化物水溶液pH>7的是NH3(填化学式);
(3)B、D、E、F四种元素的离子,其离子半径最大的是O2-(填离子符号);
(4)A2D的电子式是
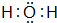 ,B、H两种元素形成化合物的电子式是
,B、H两种元素形成化合物的电子式是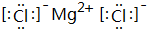 ;
;(5)A、C、H三种元素组成的化合物的化学式是NH4Cl,该化合物属于离子化合物(填“离子”或“共价”);
(6)E、F两种元素的最高价氧化物的水化物发生反应的离子方程式是Al(OH)3+OH-=AlO2-+2H2O.
18.一定条件下,向某密闭容器中加入一定量的N2和H2发生可逆反应:N2(g)+3H2(g)?2NH3 (g)测得0s到10s内,C(H2)减小了0.75mol/L,下列说法正确的是( )
| A. | 10s-15sC(NH3)增加量等于0.25 mol/L | |
| B. | 化学反应速率的关系是3v正(H2)=2v正(NH3) | |
| C. | 达到平衡后,分离出少量NH3,平衡正向移动,v正增大 | |
| D. | 保持压强不变充入Ar气体,v正减小 |
12.根据表中7种短周期元素的有关信息判断,下列说法错误的是( )
| 元素编号 | ① | ② | ② | ④ | ⑤ | ⑥ | ⑦ |
| 原子半径/nm | 0.037 | 0.074 | 0.082 | 0.099 | 0.102 | 0.143 | 0.152 |
| 最高化合价或最低化合价 | +1 | -2 | +3 | -1 | -2 | +3 | +1 |
| A. | ⑦①可形成离子化合物 | |
| B. | 元素②⑥形成的化合物具有两性 | |
| C. | 元素②氢化物的沸点小于元素⑤氢化物的沸点 | |
| D. | 元素④气态氢化物的稳定性大于元素⑤气态氢化物的稳定性 |
16.我国科学家屠哟哟因发现并提取青蒿素(化学式为C15H22O5)而获得2015年诺贝尔生理学奖或医学奖.她发现的青蒿素用以治疗疟疾,挽救了数百万患者的生命.下列关于青蒿素的叙述正确的是( )
| A. | 青蒿素属于烃 | B. | 青蒿素属于烷烃 | ||
| C. | 青蒿素属于无机化合物 | D. | 青蒿素属于有机化合物 |
17.硫酸工业是利用反应2SO2+O2?2SO3制备SO3,该反应为放热反应.温度和压强对SO2平衡转化率影响的数据如下表.
从成本角度考虑,应选用的适宜压强和温度条件是( )
| 压强/MPa | ||||
| SO2平衡 | ||||
| 转化率/% | ||||
| 温度/℃ | 0.1 | 0.5 | 1 | 10 |
| 400 | 99.2 | 99.6 | 99.7 | 99.9 |
| 500 | 93.5 | 96.9 | 97.8 | 99.3 |
| 600 | 73.7 | 85.8 | 89.5 | 96.4 |
| A. | 0.1 MPa,400℃ | B. | 0.5 MPa,500℃ | C. | 1 MPa,600℃ | D. | 10 MPa,600℃ |
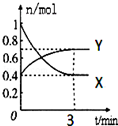 在一定温度下,体积为2L的密闭容器中,NO2和N2O4之间发生反应:2NO2(g)(红棕色)?N2O4(g)(无色),如图所示.
在一定温度下,体积为2L的密闭容器中,NO2和N2O4之间发生反应:2NO2(g)(红棕色)?N2O4(g)(无色),如图所示.