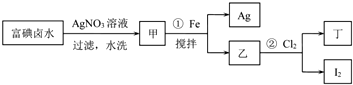
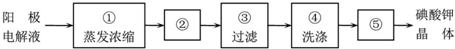
题目内容
1. 将溶液 的c(H+)、c(OH-)之比取为AG[AG=lg$\frac{c({H}^{+})}{c(O{H}^{-})}$].25℃时,用0.01mol.L-1的氢氧化钠溶液滴定20ml相同物质的量浓度的醋酸溶液,滴定曲线如图所示.下列有关叙述正确的是( )
将溶液 的c(H+)、c(OH-)之比取为AG[AG=lg$\frac{c({H}^{+})}{c(O{H}^{-})}$].25℃时,用0.01mol.L-1的氢氧化钠溶液滴定20ml相同物质的量浓度的醋酸溶液,滴定曲线如图所示.下列有关叙述正确的是( )| A. | A点时c(CH3COO-)>c(Na+) | |
| B. | 室温时0.01mol.L-1的醋酸溶液pH=6 | |
| C. | OA段溶液中均有:c(CH3COO-)>c(CH3COOH) | |
| D. | 若B点时加入NaOH溶液40mL,所得溶液中:c(CH3COO-)+2c(CH3COOH)=c(OH-)-c(H+) |
分析 A.A点AG=lg$\frac{c({H}^{+})}{c(O{H}^{-})}$=0,则c(H+)=c(OH-),结合电荷守恒判断;
B.室温时0.01mol.L-1的醋酸溶液中AG=lg$\frac{c({H}^{+})}{c(O{H}^{-})}$=6,结合c(H+)×c(OH-)=10-14计算c(H+),再根据pH=-lgc(H+);
C.醋酸为弱电解质,开始阶段c(CH3COOH)>c(CH3COO-);
D.若B点时加入NaOH溶液40mL,此时为等浓度CH3COONa、NaOH混合溶液,根据物料守恒:c(Na+)=2c(CH3COO-)+2c(CH3COOH),根据电荷守恒:c(Na+)+c(H+)=c(CH3COO-)+c(OH-).
解答 解:A.A点AG=lg$\frac{c({H}^{+})}{c(O{H}^{-})}$=0,则c(H+)=c(OH-),根据电荷守恒:c(Na+)+c(H+)=c(CH3COO-)+c(OH-),可得c(CH3COO-)=c(Na+),故A错误;
B.室温时0.01mol.L-1的醋酸溶液中AG=lg$\frac{c({H}^{+})}{c(O{H}^{-})}$=6,则$\frac{c({H}^{+})}{c(O{H}^{-})}$=106,而c(H+)×c(OH-)=10-14,联立可得c(H+)=10-4mol/L,则溶液pH=-lgc(H+)=-lg10-4=4,故B错误;
C.醋酸为弱电解质,开始阶段如O点c(CH3COOH)>c(CH3COO-),故C错误;
D.若B点时加入NaOH溶液40mL,此时为等浓度CH3COONa、NaOH混合溶液,根据物料守恒:c(Na+)=2c(CH3COO-)+2c(CH3COOH),根据电荷守恒:c(Na+)+c(H+)=c(CH3COO-)+c(OH-),联立可得:c(CH3COO-)+2c(CH3COOH)=c(OH-)-c(H+),故D正确.
故选:D.
点评 本题考查离子浓度大小比较、弱电解质的电离、pH有关计算等,关键是对AG定义的理解,离子浓度比较中等量关系判断常涉及电荷守恒、微粒守恒、质子恒等式运用.

 阅读快车系列答案
阅读快车系列答案| A. | AlCl3溶液与烧碱溶液反应,当n(OH-):n(Al3+)=7:2时,2Al3++7OH-═Al(OH)3↓+AlO2-+2H2O | |
| B. | CuCl2溶液与NaHS溶液反应,当n(CuCl2):n(NaHS)=1:2时,Cu2++2HS-═CuS↓+H2S↑ | |
| C. | Cl2与FeBr2溶液反应,当n(Cl2):n(FeBr2)=1:1时,2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl- | |
| D. | Fe与稀硝酸反应,当n(Fe):n(HNO3)=1:2时,3Fe+2NO3-+8H+═3Fe2++2NO↑+4H2O |
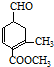 )、乙(
)、乙(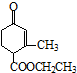 )两种有机物,下列说法中不正确的是( )
)两种有机物,下列说法中不正确的是( )| A. | 可用新制的氢氧化铜悬浊液区分这两种有机物 | |
| B. | 1 mol甲与H2在一定条件下反应,最多消耗3 mol H2 | |
| C. | 甲、乙互为同分异构体 | |
| D. | 等物质的量的甲、乙分别与足量NaOH溶液反应消耗NaOH的量相同 |

| A. | 反应Ⅰ的离子方程式为2OH-+Al2O3═2AlO2-+H2O | |
| B. | 操作a的内容包括:通入过量CO2、过滤、洗涤、灼烧 | |
| C. | 操作b为电解熔融状态的Al2O3或用CO还原Al2O3 | |
| D. | 固体b灼烧后与铝反应可用于工业上冶炼相应的金属 |
已知:Cu2O+2H+=Cu2++Cu+H2O.
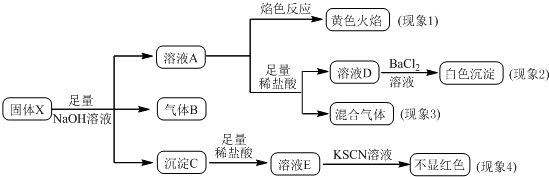
| A. | 根据现象1可推出该固体粉末中一定含有NaNO3 | |
| B. | 根据现象2可推出该固体粉末中一定含有K2SO4 | |
| C. | 根据现象3可推出该固体粉末中一定含有K2SO3 | |
| D. | 根据现象4可推出该固体粉末中一定没有Fe2O3 |
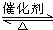 N2+4NH3;为抑制肼的分解,可采取的合理措施有降低反应温度(任写一种).
N2+4NH3;为抑制肼的分解,可采取的合理措施有降低反应温度(任写一种).
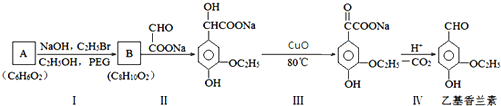
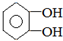 .
.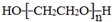 .若PEG的平均相对分子质量为17618,则其平均聚合度约为400.
.若PEG的平均相对分子质量为17618,则其平均聚合度约为400.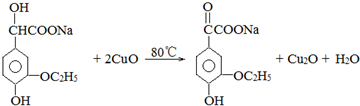 .
.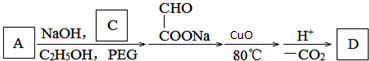
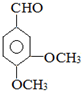 .
.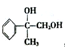 ,G可用作工业增塑剂.回答下列问题:
,G可用作工业增塑剂.回答下列问题: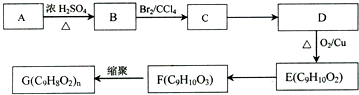
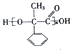 ,已知A的一种同分异构体也能转化为B,则该同分异构体的结构简式为
,已知A的一种同分异构体也能转化为B,则该同分异构体的结构简式为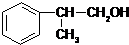 .
.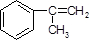 +Br2→
+Br2→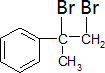 .
.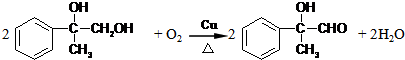 .
. .
.