题目内容
12.下列离子方程式书写不正确的是( )| A. | AlCl3溶液与烧碱溶液反应,当n(OH-):n(Al3+)=7:2时,2Al3++7OH-═Al(OH)3↓+AlO2-+2H2O | |
| B. | CuCl2溶液与NaHS溶液反应,当n(CuCl2):n(NaHS)=1:2时,Cu2++2HS-═CuS↓+H2S↑ | |
| C. | Cl2与FeBr2溶液反应,当n(Cl2):n(FeBr2)=1:1时,2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl- | |
| D. | Fe与稀硝酸反应,当n(Fe):n(HNO3)=1:2时,3Fe+2NO3-+8H+═3Fe2++2NO↑+4H2O |
分析 A.AlCl3溶液与烧碱溶液反应,当n(OH-):n(Al3+)=7:2时反应生成氢氧化铝沉淀和偏铝酸钠和水;
B.CuCl2溶液与NaHS溶液反应,当n(CuCl2):n(NaHS)=1:2时反应生成硫化铜沉淀和硫化氢;
C.Cl2与FeBr2溶液反应,当n(Cl2):n(FeBr2)=1:1时,二价铁离子全部被氧化,溴离子只氧化一半;
D.Fe与稀硝酸反应,当n(Fe):n(HNO3)=1:2时,硝酸不足,反应生成硝酸亚铁、一氧化氮和水;
解答 解:A.AlCl3溶液与烧碱溶液反应,当n(OH-):n(Al3+)=7:2时,离子方程式,2Al3++7OH-═Al(OH)3↓+AlO2-+2H2O,故A正确;
B.CuCl2溶液与NaHS溶液反应,当n(CuCl2):n(NaHS)=1:2时,离子方程式:Cu2++2HS-═CuS↓+H2S↑,故B正确;
C.氯气先氧化亚铁离子后氧化溴离子,发生反应Cl2+2Fe2+=2Cl-+2Fe3+、Cl2+2Br-=Br2+2Cl-,当n(Cl2):n(FeBr2)=1:1时,假设二者都是2mol,则亚铁离子完全被氧化需要1mol氯气、剩余1mol氯气氧化2mol溴离子,所以还有一半溴离子未被氧化,则离子方程式为2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl-,故C错误;
D.Fe与稀硝酸反应,当n(Fe):n(HNO3)=1:2时,离子方程式:3Fe+2NO3-+8H+═3Fe2++2NO↑+4H2O,故D正确;
故选:C.
点评 本题考查了离子方程式的书写,侧重考查反应物用量有关的离子反应的方程式书写,明确反应实质是解题关键,题目难度中等.

练习册系列答案
 寒假学与练系列答案
寒假学与练系列答案
相关题目
7.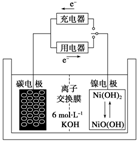 一种碳纳米管能够吸附氢气,用这种材料制备的二次电池原理如图所示,该电池的电解质为6mol•L-1KOH溶液,下列说法中正确的是( )
一种碳纳米管能够吸附氢气,用这种材料制备的二次电池原理如图所示,该电池的电解质为6mol•L-1KOH溶液,下列说法中正确的是( )
 一种碳纳米管能够吸附氢气,用这种材料制备的二次电池原理如图所示,该电池的电解质为6mol•L-1KOH溶液,下列说法中正确的是( )
一种碳纳米管能够吸附氢气,用这种材料制备的二次电池原理如图所示,该电池的电解质为6mol•L-1KOH溶液,下列说法中正确的是( )| A. | 放电时K+移向碳电极 | |
| B. | 放电时离子交换膜每通过4mol离子,碳电极质量减少12g | |
| C. | 放电时电池正极的电极反应为NiO(OH)+H2O+e-═Ni(OH)2+OH- | |
| D. | 该电池充电时将镍电极与电源的负极相连 |
17.前四周期的A、B、C、D四种元素在周期表中均与元素X紧密相邻.已知元素X最高价氧化物的化学式为X2O5,B、D同主族且B元素的原子半径是同族元素中最小的,C的最高价氧化物对应的水化物是强酸.
(1)D元素基态原子的电子排布式为1s22s22p63s23p63d104s24p3或[Ar]3d104s24p3.
(2)A、C、X三种元素原子的第一电离能由大到小的顺序为P>S>Si(用相应的元素符号作答).
(3)B、X、D氢化物的沸点由高到低的顺序为NH3>AsH3>PH3(用相应的化学式作答).
(4)E元素是A元素所在周期中电负性最大的,试推测下列微粒的立体构型:
(5)元素B的一种氢化物B2H4具有重要的用途.有关B2H4的说法正确的是AB.(选填字母)
A.B2H4分子间可形成氢键 B.B原子是sp3杂化
C.B2H4分子中含有5个σ键和1个π键 D.B2H4晶体变为液态时破坏共价键
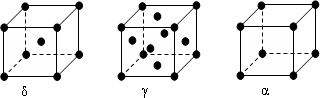
(6)F元素基态原子M层上有5对成对电子,请解释F晶体能导电的原因铁是金属晶体,由金属阳离子和自由电子组成,自由电子在外加电场的作用下可发生定向移动,因此铁能导电.F形成的单质有δ、γ、α三种同素异形体,三种晶胞(如图所示)中F原子的配位数之比为4:6:3,δ、γ、α三种晶胞的边长之比为$\frac{2}{\sqrt{3}}$:$\sqrt{2}$:1.
(1)D元素基态原子的电子排布式为1s22s22p63s23p63d104s24p3或[Ar]3d104s24p3.
(2)A、C、X三种元素原子的第一电离能由大到小的顺序为P>S>Si(用相应的元素符号作答).
(3)B、X、D氢化物的沸点由高到低的顺序为NH3>AsH3>PH3(用相应的化学式作答).
(4)E元素是A元素所在周期中电负性最大的,试推测下列微粒的立体构型:
| 微粒 | EO2- | EO3- |
| 立体构型名称 |
A.B2H4分子间可形成氢键 B.B原子是sp3杂化
C.B2H4分子中含有5个σ键和1个π键 D.B2H4晶体变为液态时破坏共价键
(6)F元素基态原子M层上有5对成对电子,请解释F晶体能导电的原因铁是金属晶体,由金属阳离子和自由电子组成,自由电子在外加电场的作用下可发生定向移动,因此铁能导电.F形成的单质有δ、γ、α三种同素异形体,三种晶胞(如图所示)中F原子的配位数之比为4:6:3,δ、γ、α三种晶胞的边长之比为$\frac{2}{\sqrt{3}}$:$\sqrt{2}$:1.

1. 将溶液 的c(H+)、c(OH-)之比取为AG[AG=lg$\frac{c({H}^{+})}{c(O{H}^{-})}$].25℃时,用0.01mol.L-1的氢氧化钠溶液滴定20ml相同物质的量浓度的醋酸溶液,滴定曲线如图所示.下列有关叙述正确的是( )
将溶液 的c(H+)、c(OH-)之比取为AG[AG=lg$\frac{c({H}^{+})}{c(O{H}^{-})}$].25℃时,用0.01mol.L-1的氢氧化钠溶液滴定20ml相同物质的量浓度的醋酸溶液,滴定曲线如图所示.下列有关叙述正确的是( )
 将溶液 的c(H+)、c(OH-)之比取为AG[AG=lg$\frac{c({H}^{+})}{c(O{H}^{-})}$].25℃时,用0.01mol.L-1的氢氧化钠溶液滴定20ml相同物质的量浓度的醋酸溶液,滴定曲线如图所示.下列有关叙述正确的是( )
将溶液 的c(H+)、c(OH-)之比取为AG[AG=lg$\frac{c({H}^{+})}{c(O{H}^{-})}$].25℃时,用0.01mol.L-1的氢氧化钠溶液滴定20ml相同物质的量浓度的醋酸溶液,滴定曲线如图所示.下列有关叙述正确的是( )| A. | A点时c(CH3COO-)>c(Na+) | |
| B. | 室温时0.01mol.L-1的醋酸溶液pH=6 | |
| C. | OA段溶液中均有:c(CH3COO-)>c(CH3COOH) | |
| D. | 若B点时加入NaOH溶液40mL,所得溶液中:c(CH3COO-)+2c(CH3COOH)=c(OH-)-c(H+) |
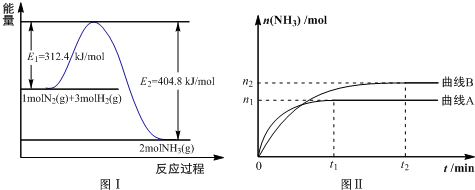
 ),它能与Fe2+形成红色配合物(如图1),该配离子中Fe2+与氮原子形成配位键共有6个.
),它能与Fe2+形成红色配合物(如图1),该配离子中Fe2+与氮原子形成配位键共有6个.
 .已知CaC2晶体密度为ag•cm-3,NA表示阿伏加德罗常数,则CaC2晶胞体积为$\frac{256}{a{N}_{A}}$cm3.
.已知CaC2晶体密度为ag•cm-3,NA表示阿伏加德罗常数,则CaC2晶胞体积为$\frac{256}{a{N}_{A}}$cm3. 燃料的使用和防污染是社会发展中一个无法回避的矛盾话题.
燃料的使用和防污染是社会发展中一个无法回避的矛盾话题.