题目内容
9.有甲(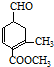 )、乙(
)、乙(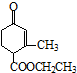 )两种有机物,下列说法中不正确的是( )
)两种有机物,下列说法中不正确的是( )| A. | 可用新制的氢氧化铜悬浊液区分这两种有机物 | |
| B. | 1 mol甲与H2在一定条件下反应,最多消耗3 mol H2 | |
| C. | 甲、乙互为同分异构体 | |
| D. | 等物质的量的甲、乙分别与足量NaOH溶液反应消耗NaOH的量相同 |
分析 A.甲含有醛基、乙没有醛基,所以可以通过检验醛基鉴别二者;
B.碳碳双键和醛基能和氢气发生加成反应;
C.二者分子式相同、结构不同的有机物互为同分异构体;
D.甲中酯基水解生成的羧基和NaOH反应,乙中之间水解生成的羧基和NaOH反应.
解答 解:A.甲含有醛基、乙没有醛基,所以可以通过检验醛基鉴别二者,所以可用新制的氢氧化铜悬浊液区分这两种有机物,故A正确;
B.碳碳双键和醛基能和氢气发生加成反应,所以1 mol甲与H2在一定条件下反应,最多消耗3 mol H2,故B正确;
C.二者分子式相同、结构不同的有机物互为同分异构体,这两种物质分子式不同,所以不是同分异构体,故C错误;
D.甲中酯基水解生成的羧基和NaOH反应,乙中之间水解生成的羧基和NaOH反应,所以等物质的量的甲、乙分别与足量NaOH溶液反应消耗NaOH的量相同,故D正确;
故选C.
点评 本题考查有机物结构和性质,为高频考点,明确官能团及其性质关系是解本题关键,利用物质性质差异性鉴别二者,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
19.下列说法正确的是( )
| A. | Na2O2是碱性氧化物 | |
| B. | Na2O2中阴阳离子个数比为1:1 | |
| C. | 可用澄清石灰水来区分Na2CO3 和NaHCO3 | |
| D. | 与同浓度盐酸反应的剧烈程度:NaHCO3>Na2CO3 |
17.前四周期的A、B、C、D四种元素在周期表中均与元素X紧密相邻.已知元素X最高价氧化物的化学式为X2O5,B、D同主族且B元素的原子半径是同族元素中最小的,C的最高价氧化物对应的水化物是强酸.
(1)D元素基态原子的电子排布式为1s22s22p63s23p63d104s24p3或[Ar]3d104s24p3.
(2)A、C、X三种元素原子的第一电离能由大到小的顺序为P>S>Si(用相应的元素符号作答).
(3)B、X、D氢化物的沸点由高到低的顺序为NH3>AsH3>PH3(用相应的化学式作答).
(4)E元素是A元素所在周期中电负性最大的,试推测下列微粒的立体构型:
(5)元素B的一种氢化物B2H4具有重要的用途.有关B2H4的说法正确的是AB.(选填字母)
A.B2H4分子间可形成氢键 B.B原子是sp3杂化
C.B2H4分子中含有5个σ键和1个π键 D.B2H4晶体变为液态时破坏共价键
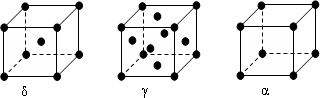
(6)F元素基态原子M层上有5对成对电子,请解释F晶体能导电的原因铁是金属晶体,由金属阳离子和自由电子组成,自由电子在外加电场的作用下可发生定向移动,因此铁能导电.F形成的单质有δ、γ、α三种同素异形体,三种晶胞(如图所示)中F原子的配位数之比为4:6:3,δ、γ、α三种晶胞的边长之比为$\frac{2}{\sqrt{3}}$:$\sqrt{2}$:1.
(1)D元素基态原子的电子排布式为1s22s22p63s23p63d104s24p3或[Ar]3d104s24p3.
(2)A、C、X三种元素原子的第一电离能由大到小的顺序为P>S>Si(用相应的元素符号作答).
(3)B、X、D氢化物的沸点由高到低的顺序为NH3>AsH3>PH3(用相应的化学式作答).
(4)E元素是A元素所在周期中电负性最大的,试推测下列微粒的立体构型:
| 微粒 | EO2- | EO3- |
| 立体构型名称 |
A.B2H4分子间可形成氢键 B.B原子是sp3杂化
C.B2H4分子中含有5个σ键和1个π键 D.B2H4晶体变为液态时破坏共价键
(6)F元素基态原子M层上有5对成对电子,请解释F晶体能导电的原因铁是金属晶体,由金属阳离子和自由电子组成,自由电子在外加电场的作用下可发生定向移动,因此铁能导电.F形成的单质有δ、γ、α三种同素异形体,三种晶胞(如图所示)中F原子的配位数之比为4:6:3,δ、γ、α三种晶胞的边长之比为$\frac{2}{\sqrt{3}}$:$\sqrt{2}$:1.

14.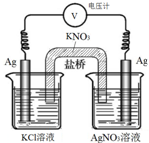 一定条件下,实验室利用如图所示装置,通过测电压求算 Ksp(AgCl).工作一段时间后,两电极质量均增大.下列说法错误的是( )
一定条件下,实验室利用如图所示装置,通过测电压求算 Ksp(AgCl).工作一段时间后,两电极质量均增大.下列说法错误的是( )
 一定条件下,实验室利用如图所示装置,通过测电压求算 Ksp(AgCl).工作一段时间后,两电极质量均增大.下列说法错误的是( )
一定条件下,实验室利用如图所示装置,通过测电压求算 Ksp(AgCl).工作一段时间后,两电极质量均增大.下列说法错误的是( )| A. | 该装置工作时化学能转化为电能 | B. | 左池中的银电极作正极 | ||
| C. | 总反应为Ag+(aq)+Cl-(aq)?AgCl(s) | D. | 盐桥中的K+向右池方向移动 |
1. 将溶液 的c(H+)、c(OH-)之比取为AG[AG=lg$\frac{c({H}^{+})}{c(O{H}^{-})}$].25℃时,用0.01mol.L-1的氢氧化钠溶液滴定20ml相同物质的量浓度的醋酸溶液,滴定曲线如图所示.下列有关叙述正确的是( )
将溶液 的c(H+)、c(OH-)之比取为AG[AG=lg$\frac{c({H}^{+})}{c(O{H}^{-})}$].25℃时,用0.01mol.L-1的氢氧化钠溶液滴定20ml相同物质的量浓度的醋酸溶液,滴定曲线如图所示.下列有关叙述正确的是( )
 将溶液 的c(H+)、c(OH-)之比取为AG[AG=lg$\frac{c({H}^{+})}{c(O{H}^{-})}$].25℃时,用0.01mol.L-1的氢氧化钠溶液滴定20ml相同物质的量浓度的醋酸溶液,滴定曲线如图所示.下列有关叙述正确的是( )
将溶液 的c(H+)、c(OH-)之比取为AG[AG=lg$\frac{c({H}^{+})}{c(O{H}^{-})}$].25℃时,用0.01mol.L-1的氢氧化钠溶液滴定20ml相同物质的量浓度的醋酸溶液,滴定曲线如图所示.下列有关叙述正确的是( )| A. | A点时c(CH3COO-)>c(Na+) | |
| B. | 室温时0.01mol.L-1的醋酸溶液pH=6 | |
| C. | OA段溶液中均有:c(CH3COO-)>c(CH3COOH) | |
| D. | 若B点时加入NaOH溶液40mL,所得溶液中:c(CH3COO-)+2c(CH3COOH)=c(OH-)-c(H+) |
18.高氯酸、硫酸、硝酸和盐酸都是强酸,其酸性在水溶液中差别不大.四种物质在冰醋酸中的电离常数
从以上表格中判断以下说法中不正确的是( )
| HClO4 | H2SO4 | HCl | HNO3 | |
| Ka | 1.6×10-5 | 6.3×10-9 | 1.6×10-9 | 4.2×10-10 |
| A. | 在冰醋酸中高氯酸是这四种酸中最强的酸 | |
| B. | 在冰醋酸中硫酸的电离方程式为H2SO4═2H++SO42- | |
| C. | 在冰醋酸中这四种酸都没有完全电离 | |
| D. | 酸的强弱与其本身的结构和溶剂的性质有关 |
19.下列物质中,属于新型无机非金属材料的是( )
| A. | 钢化玻璃 | B. | 氮化硅陶瓷 | C. | 光导纤维 | D. | 陶瓷 |
 ),它能与Fe2+形成红色配合物(如图1),该配离子中Fe2+与氮原子形成配位键共有6个.
),它能与Fe2+形成红色配合物(如图1),该配离子中Fe2+与氮原子形成配位键共有6个.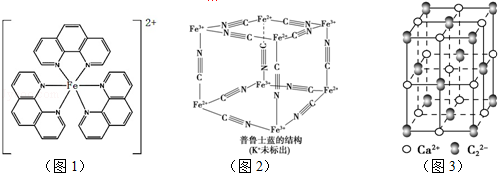
 .已知CaC2晶体密度为ag•cm-3,NA表示阿伏加德罗常数,则CaC2晶胞体积为$\frac{256}{a{N}_{A}}$cm3.
.已知CaC2晶体密度为ag•cm-3,NA表示阿伏加德罗常数,则CaC2晶胞体积为$\frac{256}{a{N}_{A}}$cm3. 燃料的使用和防污染是社会发展中一个无法回避的矛盾话题.
燃料的使用和防污染是社会发展中一个无法回避的矛盾话题.