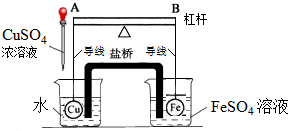
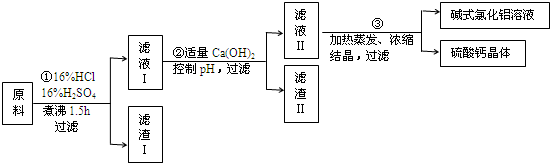
题目内容

(1)过滤时需要用到的玻璃仪器是(填2个)
(2)检验加入BaCl2溶液后SO42-是否沉淀完全的操作为
(3)若用硝酸钡来代替氯化钡,请判断是否可行,并说明理由
(4)某同学认为该实验方案中加适量氯化钡溶液不容易控制,应加入过量氯化钡溶液.
他的思路如下:
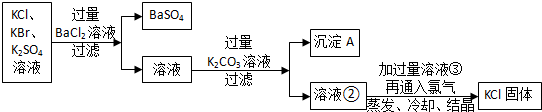
沉淀A的化学式是
考点:物质分离和提纯的方法和基本操作综合应用
专题:实验设计题
分析:(1)过滤一般用到烧杯、漏斗、玻璃棒以及滤纸等;
(2)可用钡离子检验,硫酸钡不溶于硝酸;
(3)若用硝酸钡来代替氯化钡,引入新杂质;
(4)氯化钾、溴化钾,硫酸钾中硫酸钾能与氯化钡反应生成硫酸钡白色沉淀,溶液①的成分中含有:氯化钾、溴化钾和过量的氯化钡,加入过量碳酸钾,会和氯化钡反应生成碳酸钡白色沉淀和氯化钾,所以沉淀A的化学式是BaCO3;溶液②的成分中含有氯化钾、溴化钾和过量的碳酸钾,碳酸钾会和③盐酸反应生成氯化钾、水和二氧化碳,可以将碳酸根离子除掉,溴化钾会与氯气反应生成氯化钾和溴单质,以此解答.
(2)可用钡离子检验,硫酸钡不溶于硝酸;
(3)若用硝酸钡来代替氯化钡,引入新杂质;
(4)氯化钾、溴化钾,硫酸钾中硫酸钾能与氯化钡反应生成硫酸钡白色沉淀,溶液①的成分中含有:氯化钾、溴化钾和过量的氯化钡,加入过量碳酸钾,会和氯化钡反应生成碳酸钡白色沉淀和氯化钾,所以沉淀A的化学式是BaCO3;溶液②的成分中含有氯化钾、溴化钾和过量的碳酸钾,碳酸钾会和③盐酸反应生成氯化钾、水和二氧化碳,可以将碳酸根离子除掉,溴化钾会与氯气反应生成氯化钾和溴单质,以此解答.
解答:
解:(1)过滤一般用到烧杯、漏斗、玻璃棒以及滤纸等,则玻璃仪器为漏斗、玻璃棒、烧杯,故答案为:漏斗、玻璃棒、烧杯;
(2)可用硝酸酸化的硝酸钡检验硫酸根离子,方法为静置一段时间后,取少量上层清液于试管中,再滴加BaCl2溶液,若无沉淀生成,说明SO42-沉淀完全,反之未沉淀完全,
故答案为:静置一段时间后,取少量上层清液于试管中,再滴加BaCl2溶液,若无沉淀生成,说明SO42-沉淀完全,反之未沉淀完全;
(3)若用硝酸钡来代替氯化钡,则硝酸根在溶液中不能除掉,引入新杂质,不可行,故答案为:不可行,会引入NO3-;
(4)氯化钾、溴化钾,硫酸钾中硫酸钾能与氯化钡反应生成硫酸钡白色沉淀,溶液①的成分中含有:氯化钾、溴化钾和过量的氯化钡,加入过量碳酸钾,会和氯化钡反应生成碳酸钡白色沉淀和氯化钾,所以沉淀A的化学式是BaCO3;溶液②的成分中含有氯化钾、溴化钾和过量的碳酸钾,碳酸钾会和③盐酸反应生成氯化钾、水和二氧化碳,可以将碳酸根离子除掉,溴化钾会与氯气反应生成氯化钾和溴单质,
故答案为:BaCO3; HCl.
(2)可用硝酸酸化的硝酸钡检验硫酸根离子,方法为静置一段时间后,取少量上层清液于试管中,再滴加BaCl2溶液,若无沉淀生成,说明SO42-沉淀完全,反之未沉淀完全,
故答案为:静置一段时间后,取少量上层清液于试管中,再滴加BaCl2溶液,若无沉淀生成,说明SO42-沉淀完全,反之未沉淀完全;
(3)若用硝酸钡来代替氯化钡,则硝酸根在溶液中不能除掉,引入新杂质,不可行,故答案为:不可行,会引入NO3-;
(4)氯化钾、溴化钾,硫酸钾中硫酸钾能与氯化钡反应生成硫酸钡白色沉淀,溶液①的成分中含有:氯化钾、溴化钾和过量的氯化钡,加入过量碳酸钾,会和氯化钡反应生成碳酸钡白色沉淀和氯化钾,所以沉淀A的化学式是BaCO3;溶液②的成分中含有氯化钾、溴化钾和过量的碳酸钾,碳酸钾会和③盐酸反应生成氯化钾、水和二氧化碳,可以将碳酸根离子除掉,溴化钾会与氯气反应生成氯化钾和溴单质,
故答案为:BaCO3; HCl.
点评:本题综合考查物质的制备和提纯等知识,侧重于学生的分析能力、实验能力和计算能力的考查,为高考常见题型,注意把握实验的操作原理和步骤,把握相关物质的性质,难度中等.

练习册系列答案
相关题目
化合物丙由如下反应得到:丙的结构简式不可能是( )


| A、CH3CH2CHBrCH2Br |
| B、CH3CH(CH2Br)2 |
| C、CH3CHBrCHBrCH3 |
| D、(CH3)2CBrCH2Br |
下列氢化物的性质按顺序排列正确的是( )
| A、HI、HBr、HCl、HF(酸性减弱) |
| B、HCl、H2S、PH3、SiH4(稳定性减弱) |
| C、H2O、H2S、HCl、HBr(还原性增强) |
| D、HF、H2O、PH3、NH3 (稳定性减弱) |