题目内容
9.某短周期非金属元素的原子核外最外层电子数是次外层电子数的一半,该元素( )| A. | 在自然界中只以化合态的形式存在,形成的单质是良好的半导体材料 | |
| B. | 单质常用作半导体材料和光导纤维 | |
| C. | 最高价氧化物是酸性氧化物,不能与酸反应 | |
| D. | 最高价氧化物对应的水化物的酸性比磷酸强 |
分析 某非金属元素的原子核外最外层电子数是次外层电子数的一半,最外层电子数不能超过8个,如果最外层是L层,则为Li元素,不属于非金属元素,如果最外层是M层,则为Si元素,所以该元素就是Si元素,以此解答该题.
解答 解:由以上分析可知该元素为Si.
A.Si是亲氧元素,所以在自然界中Si都以化合态存在,且硅的单质具有导电性,是良好的半导体材料,故A正确;
B.硅不能用于光导纤维,制备光导纤维的材料为二氧化硅,故B错误;
C.二氧化硅可与氢氟酸反应,故C错误;
D.非金属性Si<P,则硅酸的酸性比磷酸弱,故D错误.
故选A.
点评 本题考查原子结构与元素化合物性质,为高频考点,侧重考查学生的分析能力,难度不大,注意掌握Si元素单质化合物性质的特殊性.

练习册系列答案
 习题精选系列答案
习题精选系列答案
相关题目
19.提纯分离下述物质时,采用的方法与制取无水乙醇的方法相同的是( )
| A. | 分离硬脂酸和甘油 | B. | 除去乙醛中少量醋酸 | ||
| C. | 分离苯酚和苯 | D. | 除去甲烷中少量乙烯 |
20.下列分子的比例模型中,中心原子上存在孤电子对的是( )
| A. |  | B. |  | C. |  | D. |  |
17.向 50mL 18mol/L 的浓硫酸中加入足量的铜片并加热,充分反应后,待溶液冷却后加入足量BaCl2 溶液,生成沉淀的物质的量是( )
| A. | 等于0.9mol | B. | 等于0.45mol | C. | 小于0.45 mol | D. | 大于0.45 mol |
4.下列氧化还原反应中氧化剂和还原剂不是同一种物质的是( )
| A. | 2H2O$\frac{\underline{\;MnO_{2}\;}}{\;}$2H2O+O2↑ | |
| B. | 3Cl2+6NaOH $\frac{\underline{\;\;△\;\;}}{\;}$5NaCl+NaClO3+3H2O | |
| C. | 2Na2O2+2CO2═2Na2CO3+O2 | |
| D. | 2H2S+H2SO4(浓)=S↓+SO2↑+2H2O |
14.室温下,下列关亍电解质的说法中正确的是( )
| A. | 中和等体积、等浓度的氨水和氢氧化钠溶液至pH等于7,前者消耗的盐酸多 | |
| B. | 向NaHS 溶液中加入适量 KOH 后:c(Na+)═c(H2S)+c(HS-)+c(S2-) | |
| C. | 将amol•L-1的醋酸与0.01 mol•L-1的氢氧化钠溶液等体积混合,溶液中:c(Na+)=c(CH3COO-),醋酸的电离常数Ka=$\frac{2×1{0}^{-9}}{a-0.01}$ (用含a的代数式表示) | |
| D. | 向NH4Cl溶液中加入少量等浓度的稀盐酸,则$\frac{c(N{{H}_{4}}^{+})}{c(N{H}_{3}•{H}_{2}O)}$的值减小 |
1.室温下,下列有关电解质溶液的说法正确的是( )
| A. | 向0.1mol/L的醋酸溶液中加大量水稀释后溶液中$\frac{{c({H^+})}}{{c(C{H_3}CO{O^-})}}$不变 | |
| B. | 向0.1mol/L的醋酸溶液中加大量水稀释后溶液中$\frac{{c({H^+})}}{{c(C{H_3}CO{O^-})}}$变小 | |
| C. | 向蒸馏水中加入Na2O,水的电离程度变小 | |
| D. | 将pH=3的醋酸溶液稀释到原体积的10倍后,溶液的pH=4 |
9.下列有关物质的性质和该性质的应用均正确的是( )
| A. | NH3溶于水后显碱性,在FeCl3饱和溶液中通入足量NH3可制取Fe(OH)3胶体 | |
| B. | 碳酸钠溶液显碱性,用热的碳酸钠溶液可去除金属表面的油污 | |
| C. | 氢氟酸具有强酸性,可用于雕刻玻璃 | |
| D. | 铜的金属活动性比铝弱,可用铜罐代替铝罐贮运浓硝酸 |
10.已知酸性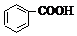 >H2CO3>
>H2CO3> >HCO3-,向Na2CO3溶液中逐滴加入水杨酸(
>HCO3-,向Na2CO3溶液中逐滴加入水杨酸( )溶液,可能发生的反应的离子方程式书写正确的是( )
)溶液,可能发生的反应的离子方程式书写正确的是( )
 >H2CO3>
>H2CO3> >HCO3-,向Na2CO3溶液中逐滴加入水杨酸(
>HCO3-,向Na2CO3溶液中逐滴加入水杨酸( )溶液,可能发生的反应的离子方程式书写正确的是( )
)溶液,可能发生的反应的离子方程式书写正确的是( )| A. | 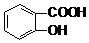 +CO32-→ +CO32-→ +HCO3- +HCO3- | B. |  +CO32-→ +CO32-→ +H2O+CO2↑ +H2O+CO2↑ | ||
| C. | 2 +CO32-→2 +CO32-→2 +CO2↑ +CO2↑ | D. | 3 +2CO32-→3 +2CO32-→3 +HCO3-+H2O+CO2↑ +HCO3-+H2O+CO2↑ |