题目内容
7.氯化铜、氯化亚铜是重要的化工原料,广泛地用作有机合成催化剂.实验室中以粗铜(含杂质Fe)为原料,一种制备铜的氯化物的流程如图1.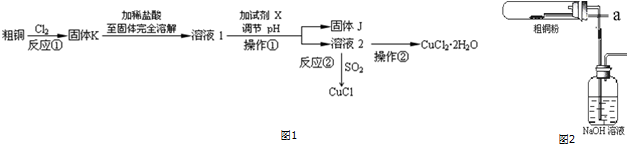
按要求回答下列问题:
(1)操作①的名称是过滤,检验溶液2中是否含有杂质离子的试剂是KSCN溶液或苯酚.
(2)上述流程中,所得固体K需要加稀盐酸溶解,其理由是抑制氯化铜、氯化铁水解;
溶液1可加试剂X用于调节pH,以除去杂质,试剂 X和固体J分别是(填序号)c.
a.NaOH Fe(OH)b.NH3•H2O Fe(OH)2
c.CuO Fe(OH)3 d.CuSO4 Cu(OH)2
(3)反应②是向溶液2中通入一定量的SO2,加热一段时间后生成CuCl白色沉淀.写出制备CuCl的离子方程式:2Cu2++2Cl-+SO2+2H2O$\frac{\underline{\;\;△\;\;}}{\;}$2CuCl↓+4H++SO42-.
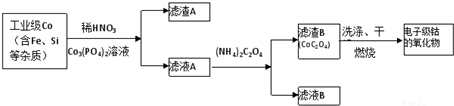
(4)如图2所示将氯气从a通入与粗铜反应(铁架台、铁夹、酒精灯省略),
①反应时,盛粗铜粉的试管中的现象是产生大量棕黄色烟.
②反应后,盛有NaOH溶液的广口瓶中溶液具有漂白、消毒作用,若用钢铁(含Fe、C)制品盛装该溶液会发生电化学腐蚀,钢铁制品表面生成红褐色沉淀,溶液会失去漂白、杀菌消毒功效.该电化学腐蚀过程中的正极反应式为ClO-+2e-+H2O=Cl-+2OH-.
分析 粗铜(含杂质Fe)与氯气反应生成氯化铁和氯化铜,加稀盐酸溶解,形成氯化铁和氯化铜溶液,同时抑制氯化铜、氯化铁水解,溶液1中加入X调节溶液pH,得到溶液乙,经过系列操作得到CuCl2•2H2O,故溶液2为CuCl2溶液,则调节pH目的是使溶液中铁离子转化为Fe(OH)3沉淀,过滤除去,试剂X可以为CuO、氢氧化铜等,结合题目信息可知,氯化铜溶液,加少量盐酸,抑制氯化铜水解,再蒸发浓缩、冷却结晶得到CuCl2•2H2O,再经过过滤、洗涤、干燥得到纯净的晶体.
(1)操作①是分离固体和液体混合物的操作;溶液2中若含有杂质离子则是Fe3+,用KSCN溶液或苯酚检验;
(2)氯化铜、氯化铁在溶液中会发生水解,铜盐水解生成氢氧化铜,保持溶液呈强酸性,避免铜离子水解损失,调节pH目的是使溶液中铁离子转化为Fe(OH)3沉淀;
(3)根据信息可知:SO2与铜离子反应生成CuCl白色沉淀和SO42-;
(4)①Cu与Cl2反应产生大量棕黄色烟(CuCl2);
②正极上ClO-得电子生成Cl-.
解答 解:粗铜(含杂质Fe)与氯气反应生成氯化铁和氯化铜,加稀盐酸溶解,形成氯化铁和氯化铜溶液,同时抑制氯化铜、氯化铁水解,溶液1中加入X调节溶液pH,得到溶液乙,经过系列操作得到CuCl2•2H2O,故溶液2为CuCl2溶液,则调节pH目的是使溶液中铁离子转化为Fe(OH)3沉淀,过滤除去,试剂X可以为CuO、氢氧化铜等,结合题目信息可知,氯化铜溶液,加少量盐酸,抑制氯化铜水解,再蒸发浓缩、冷却结晶得到CuCl2•2H2O,再经过过滤、洗涤、干燥得到纯净的晶体.
(1)操作①是分离固体和液体混合物的操作,所以操作①的名称是过滤,溶液2中若含有杂质离子则是Fe3+,用KSCN溶液或苯酚检验,
故答案为:过滤;KSCN溶液或苯酚;
(2)氯化铜、氯化铁中的金属离子易水解,直接用水溶液配制溶液会产生浑浊,所以加入过量的盐酸来溶解氯化铜、氯化铁,以抑制氯化铜、氯化铁水解;用于调节pH以除去溶液1杂质可加试剂具有与酸反应,且不引入Cu2+之外的离子,故用CuO或Cu2(OH)或Cu2(OH)2CO3,调节pH目的是使溶液中铁离子转化为Fe(OH)3沉淀,过滤除去,且不能引入新杂质,
故答案为:抑制氯化铜、氯化铁水解;c;
(3)根据信息可知:在加热条件下,SO2与铜离子反应生成CuCl白色沉淀和SO42-,其反应的离子方程式为:2Cu2++2Cl-+SO2+2H2O$\frac{\underline{\;\;△\;\;}}{\;}$2CuCl↓+4H++SO42-,
故答案为:2Cu2++2Cl-+SO2+2H2O$\frac{\underline{\;\;△\;\;}}{\;}$2CuCl↓+4H++SO42-;
(4)①Cu与Cl2反应产生大量棕黄色烟(CuCl2),则反应时盛粗铜粉的试管中的现象是产生大量棕黄色烟,
故答案为:产生大量棕黄色烟;
②反应后,盛有NaOH溶液的广口瓶中生成NaClO溶液,该溶液具有漂白、消毒作用,若用钢铁(含Fe、C)制品盛装该溶液会发生电化腐蚀,ClO-得电子作正极生成Cl-,则正极上的电极方程式为:ClO-+2e-+H2O=Cl-+2OH-,
故答案为:ClO-+2e-+H2O=Cl-+2OH-.
点评 本题以实验室制备氯化铜为背景,考查了物质的制备实验操作、离子检验、除杂质、离子方程式的书写、原电池原理的应用等,题目涉及的知识点较多,侧重于基础知识的综合应用的考查.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案①福尔马林 ②酒精 ③KMnO4溶液 ④硫酸钠 ⑤硝酸银溶液 ⑥双氧水 ⑦硝酸.
| A. | 除④⑦外 | B. | 除③⑥外 | C. | ①②⑤ | D. | 除④外 |
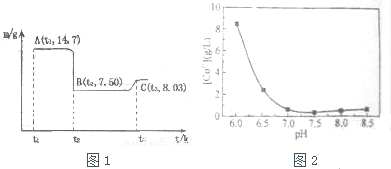
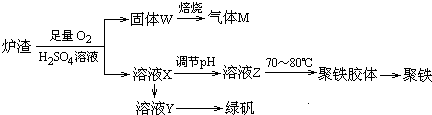
(1)滤渣A的成分除过量的Co的磷酸盐和Fe(OH)3外还有Si(填化学式).
(2)加入CO3(PO4)2的目的是调节溶液pH,保证Co2+不沉淀,而使铁离子全部沉淀.
(3)Co与稀硝酸反应生成 Co2+的离子方程式为:3Co+8H++2NO3-═3Co2++4H2O+2NO↑.
(4)滤渣B经过反复洗涤、干燥后,进行灼烧,其热重分析图如图1,写出C点物质的化学式:Co3O4
(5)上述制备过程中采用草酸盐作为沉淀剂,由于生产成本较高,某科研小组研究从钴渣酸浸液(主要成分为CoSO4、Fe2(SO4)3、Al2(SO4)3)出发,以碳铵(NH4HCO3)代替草酸盐作沉淀剂,并由此制备氧化钴.请结合相关信息,补充完整实验步骤.
已知:a.金属离子生成氢氧化物沉淀pH如下表(开始沉淀pH按金属离子1mol/L计算)
| 开始沉淀的pH | 完全溶解的pH | |
| Fe3+ | 1.1 | 3.2 |
| Al3+ | 3.0 | 5.0 |
| Co2+ | 7.2 | 9.2 |
由钴渣酸浸液制备氧化钴的实验步骤依次为:
①往钴渣酸浸液中滴加NaOH溶液,调节溶液pHpH(5.0,7.2),使Fe3+、Al3+沉淀完全;
②过滤;③配制一定浓度的碳铵溶液,缓慢加入到滤液中,搅拌,控制pH至7.0左右,使Co2+沉淀完全,过滤;
④将蒸馏水加热至70℃以上,洗涤CoCO3沉淀3次,干燥;
⑤400℃焙烧3h,得产品氧化钴.
方法一:将碳酸锂、乙酸亚铁[(CH3COO)2Fe]、磷酸二氢铵按一定比例混合、充分研磨后,在800℃左右、惰性气体氛围中煅烧制得晶态磷酸亚铁锂,同时生成的乙酸及其它产物均以气体逸出.
方法二:将一定浓度的磷酸二氢铵、氯化锂混合溶液作为电解液,以铁棒为阳极,石墨为阴极,电解析出磷酸亚铁锂沉淀.沉淀经过滤、洗涤、干燥,在800℃左右、惰性气体氛围中煅烧制得晶态磷酸亚铁锂.
方法三:某化工厂以铁红、锂辉石LiAl(SiO3)2(含少量Ca2+、Mg2+的盐)、碳粉等原料来生产磷酸亚铁锂.其主要工艺流程如图:

已知:2LiAl(SiO3)2+H2SO4(浓)$\frac{\underline{\;250-300℃\;}}{\;}$Li2SO4+Al2O3•4SiO2•H2O↓
| 温度/℃ | 20 | 40 | 60 | 80 |
| 溶解度(Li2CO3)/g | 1.33 | 1.17 | 1.01 | 0.85 |
| 溶解度(Li2SO4)/g | 34.2 | 32.8 | 31.9 | 30.7 |
(1)在方法一所发生的反应中,除生成磷酸亚铁锂、乙酸外,还有H2OCO2、NH3(填化学式)等气体生成.
(2)在方法二中,阳极生成磷酸亚铁锂的电极反应式为Fe+H2PO4-+Li+-2e-=LiFePO4+2H+
(3)在方法三中,从滤渣Ⅰ中可分离出Al2O3,如图所示.

①请写出生成沉淀的离子方程式Al3++3NH3•H2O=Al(OH)3↓+3NH4+
②滤渣Ⅱ的主要成分是:Mg(OH)2、CaCO3(填化学式).
③写出在高温下生成磷酸亚铁锂的化学方程式2FePO4+Li2CO3+2C$\frac{\underline{\;高温\;}}{\;}$2LiFePO4+3CO↑.
(4)在锂离子电池中,需要一种有机聚合物作为正负极之间锂离子迁移的介质,该有机聚合物的单体之一的结构简式如下:
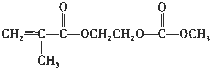 ,写出该单体与足量氢氧化钠溶液反应的化学方程式:
,写出该单体与足量氢氧化钠溶液反应的化学方程式: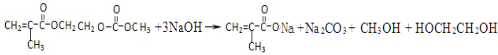 .
.(5)磷酸铁锂动力电池(简称LFP)是一种高效、长寿命的二次电池,其工作原理为:C6Li+FePO4$?_{充电}^{放电}$C6Li(1-x)+(1-x)FePO4+xLiFePO4,电池充电时,阳极中的Li+通过聚合物隔膜向阴极迁移;在放电时,负极中Li+的通过隔膜向正极迁移.充电时的阴极反应式C6Li(1-x)+xLi++xe-═C6Li,若用该电池电解精炼铜,阴极质量增重12.8g,则电池中经过聚合物隔膜的Li+数目为0.4NA.
| A. | 14C可用于测定一些文物的年代,该过程是化学变化 | |
| B. | 烧结粘土制陶瓷是物理变化 | |
| C. | 服用阿司匹林出现水杨酸反应时,用碳酸氢钠溶液解毒是复分解反应 | |
| D. | 从海水中提取镁的过程中,发生的是非氧化还原反应 |
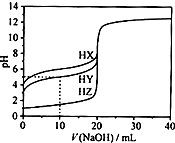 25℃时,用浓度为0.1000mol•L-1的NaOH溶液滴定20.00mL浓度均为0.1000mol•L-1的三种酸HX、HY、HZ滴定曲线如图所示.下列说法正确的是( )
25℃时,用浓度为0.1000mol•L-1的NaOH溶液滴定20.00mL浓度均为0.1000mol•L-1的三种酸HX、HY、HZ滴定曲线如图所示.下列说法正确的是( )| A. | 在相同温度下,同浓度的三种酸溶液的酸性强弱顺序:HZ<HY<HX | |
| B. | HZ、HY、HX均为弱酸 | |
| C. | 向HY溶液中加入10.00mLNaOH溶液,一定有c(Y-)+c(OH-)═c(H+)+c(Na+) | |
| D. | 将上述HX、HY溶液等体积混合后,用NaOH溶液滴定至HX恰好完全反应时:c(X-)>c(Y-)>c(OH-)>c(H+) |
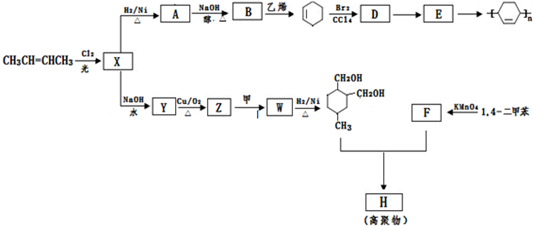
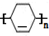
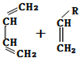 →
→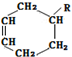 (或写成
(或写成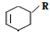 R代表取代基或氢)
R代表取代基或氢)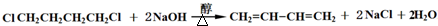 ;
;
 ;
;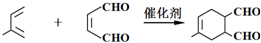 .
.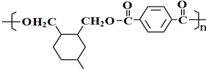 .
.