题目内容
10.下列指定微粒的数目相等的是( )| A. | 等物质的量的CaCl2和CaO2含有的离子数 | |
| B. | 等质量的水与重水含有的电子数 | |
| C. | 同温、同压同体积的CO和NO含有的质子数 | |
| D. | 等物质的量的铁和铝分别与足量氯气完全反应时转移的电子数 |
分析 A、1mol氯化钙中含有3mol的离子,而1mol过氧化钙中含有2mol的离子;
B、等物质量的水与重水含有的电子数相等;
C、同温、同压同体积的CO和NO物质的量相等,而等物质量的CO和NO含有的质子数不等;
D、铁与铝反应分别生成氯化铁和氯化铝.
解答 解:A、1mol氯化钙中含有3mol的离子,而1mol过氧化钙中含有2mol的离子,所以等物质的量的CaCl2和CaO2含有的离子数不相等,故A错误;
B、等物质量的水与重水含有的电子数相等,而水和重水的摩尔质量不等,所以等质量的水与重水物质的量不等,故B错误;
C、同温、同压同体积的CO和NO物质的量相等,而等物质量的CO和NO含有的质子数不等,故C错误;
D、铁与铝反应分别生成氯化铁和氯化铝,所以等物质的量的铁和铝分别与足量氯气完全反应时转移的电子数相等地,故D正确;
故选D.
点评 本题考查物质的量有关计算,难度不大,注意CaO2中由钙离子和过氧根离子构成,而不是氧负离子.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
11.某化学兴趣小组制取氯酸钾和氯水并进行有关探究实验.
实验一 制取氯酸钾和氯水
利用如图1所示的实验装置进行实验.
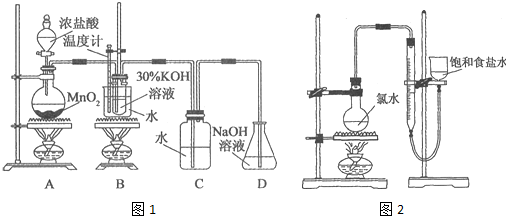
(1)制取实验结束后,取出B中试管冷却结晶,过滤,洗涤.该实验操作过程需要的玻璃仪器有烧杯、漏斗、玻璃棒、胶头滴管.
(2)若对调B和C装置的位置,能(填“能”或“不能”)提高B中氯酸钾的产率.
实验二 氯酸钾与碘化钾反应的研究
(3)在不同条件下KClO3可将KI氧化为I2或KIO3.该小组设计了系列实验研究反应条件对反应产物的影响,其中系列a实验的记录如下(实验在室温下进行):
①系列a实验的实验目的是研究反应体系中硫酸浓度对反应产物的影响.
②设计1号试管实验的作用是硫酸浓度为0的对照实验.
③若2号试管实验现象为“黄色溶液”,取少量该溶液加入淀粉溶液显蓝色;假设氧化产物唯一,还原产物为KCl,则此反应的离子方程式为ClO3-+6I-+6H+=Cl-+3I2+3H2O.
实验三 测定饱和氯水中氯元素的总量
(4)该小组设计的实验方案为:使用如图2装置,加热15.0mL饱和氯水试样,测定产生气体的体积.此方案不可行的主要原因是因存在氯气的重新溶解以及次氯酸分解等,此方案无法测算试样含氯总量.(不考虑实验装置及操作失误导致不可行的原因)
(5)根据下列资料,为该小组设计一个可行的实验方案(不必描述操作过程的细节):量取一定量的试样,加入足量的H2O2溶液,充分反应,再加入足量的硝酸银溶液,称量沉淀质量.
资料:i.次氯酸会破坏酸碱指示剂;
ii.次氯酸或氯气可被SO2、H2O2和FeCl2等物质还原成Cl-.
实验一 制取氯酸钾和氯水
利用如图1所示的实验装置进行实验.

(1)制取实验结束后,取出B中试管冷却结晶,过滤,洗涤.该实验操作过程需要的玻璃仪器有烧杯、漏斗、玻璃棒、胶头滴管.
(2)若对调B和C装置的位置,能(填“能”或“不能”)提高B中氯酸钾的产率.
实验二 氯酸钾与碘化钾反应的研究
(3)在不同条件下KClO3可将KI氧化为I2或KIO3.该小组设计了系列实验研究反应条件对反应产物的影响,其中系列a实验的记录如下(实验在室温下进行):
| 试管编号 | 1 | 2 | 3 | 4 |
| 0.2mol•L-1KI/mL | 1.0 | 1.0 | 1.0 | 1.0 |
| KClO3(s)/g | 0.10 | 0.10 | 0.10 | 0.10 |
| 6.0mol•L-1H2SO4/mL | 0 | 3.0 | 6.0 | 9.0 |
| 蒸馏水/mL | 9.0 | 6.0 | 3.0 | 0 |
| 实验现象 |
②设计1号试管实验的作用是硫酸浓度为0的对照实验.
③若2号试管实验现象为“黄色溶液”,取少量该溶液加入淀粉溶液显蓝色;假设氧化产物唯一,还原产物为KCl,则此反应的离子方程式为ClO3-+6I-+6H+=Cl-+3I2+3H2O.
实验三 测定饱和氯水中氯元素的总量
(4)该小组设计的实验方案为:使用如图2装置,加热15.0mL饱和氯水试样,测定产生气体的体积.此方案不可行的主要原因是因存在氯气的重新溶解以及次氯酸分解等,此方案无法测算试样含氯总量.(不考虑实验装置及操作失误导致不可行的原因)
(5)根据下列资料,为该小组设计一个可行的实验方案(不必描述操作过程的细节):量取一定量的试样,加入足量的H2O2溶液,充分反应,再加入足量的硝酸银溶液,称量沉淀质量.
资料:i.次氯酸会破坏酸碱指示剂;
ii.次氯酸或氯气可被SO2、H2O2和FeCl2等物质还原成Cl-.
1.下列操作或装置能达到实验目的是( )
| A. |  配制一定浓度的NaCl溶液 | B. |  实验室制取乙酸乙酯 | ||
| C. |  检验乙炔的还原性 | D. |  分离水和硝酸苯 |
18.下列各组物质中,互称为同分异构体的是( )
| A. | 水与冰 | B. | O2与O3 | C. |  与 与  | D. |  与 与 |
5.为探究锌与稀硫酸的反应速率[ν(H2)],向反应混合液中加入某些物质,下列判断正确的是( )
| A. | 加入NaHSO4固体,ν(H2)不变 | B. | 加入少量水,ν(H2)减小 | ||
| C. | 加入CH3COONa固体,ν(H2)不变 | D. | 滴加少量CuSO4溶液,ν(H2)减小 |
2.Cu片放入0.1 mol•L-1FeCl3溶液中,反应一定时间后取出Cu片,测得溶液中Fe3+和Fe2+的物质的量浓度为:c(Fe3+):c(Fe2+)=2:3,则溶液中Cu2+与Fe3+的物质的量之比为( )
| A. | 3:2 | B. | 3:5 | C. | 3:4 | D. | 4:3 |
19.某可充电的锂电池以LiMnO4为正极,嵌入锂的碳材料为负极.含Li+导电固体为电解质.放电时的电池反应为:Li+LiMn2O4═Li2Mn2O4.下列说话正确的是( )
| A. | 放电时,LiMn2O4发生氧化反应 | |
| B. | 放电时.正极反应为Li++LiMn2O4+e-═Li2Mn2O4 | |
| C. | 充电时.LiMn2O4发生氧化反应 | |
| D. | 锂离子电池的比能量(单位质量释放的能量)低 |
20.下面是碳在足量的氧气中燃烧的化学方程式,其中正确的是( )
| A. | C+O2$\frac{\underline{\;点燃\;}}{\;}$CO2 | B. | 2C+O2$\frac{\underline{\;点燃\;}}{\;}$2CO | ||
| C. | CO2+C$\frac{\underline{\;高温\;}}{\;}$2CO | D. | 2CO+O2$\frac{\underline{\;点燃\;}}{\;}$2CO2 |
