题目内容
19.某可充电的锂电池以LiMnO4为正极,嵌入锂的碳材料为负极.含Li+导电固体为电解质.放电时的电池反应为:Li+LiMn2O4═Li2Mn2O4.下列说话正确的是( )| A. | 放电时,LiMn2O4发生氧化反应 | |
| B. | 放电时.正极反应为Li++LiMn2O4+e-═Li2Mn2O4 | |
| C. | 充电时.LiMn2O4发生氧化反应 | |
| D. | 锂离子电池的比能量(单位质量释放的能量)低 |
分析 根据电池总反应式Li+LiMn2O4═Li2Mn2O4,可知原电池放电时,Li为负极,被氧化,电极反应式为Li-e-═Li+,正极得电子被还原,电极反应式为Li++LiMn2O4+e-═Li2Mn2O4,以此解答该题.
解答 解:A.由总反应式可知,放电时,Mn元素化合价降低,LiMn2O4发生还原反应,故A错误;
B.正极LiMn2O4得电子被还原,电极反应式为Li++LiMn2O4+e-═Li2Mn2O4,故B正确;
C.充电时,反应向左进行,Li2Mn2O4被氧化,故C错误;
D.由于锂的相对原子质量较小,单位质量释放的能量较多,则锂离子电池的比能量较高,故D错误.
故选B.
点评 本题考查原电池知识,为高频考点,侧重于学生的分析能力的考查,题目难度中等,本题注意明确电极反应方程式以及电极反应类型为解答该题的关键.

练习册系列答案
 名校通行证有效作业系列答案
名校通行证有效作业系列答案
相关题目
10.下列指定微粒的数目相等的是( )
| A. | 等物质的量的CaCl2和CaO2含有的离子数 | |
| B. | 等质量的水与重水含有的电子数 | |
| C. | 同温、同压同体积的CO和NO含有的质子数 | |
| D. | 等物质的量的铁和铝分别与足量氯气完全反应时转移的电子数 |
7.常温下,将0.1000mol•L-1 NaOH溶液滴入20.00mL 0.1000mol•L-1的一元酸HA溶液中,测得混合溶液的pH变化曲线如图所示.下列说法正确的是( )

| A. | ①点所示溶液中:c(A-)+c(OH-)=c(HA)+c(H+) | |
| B. | ②点所示溶液中:c(Na+)>c(HA)>c(A-)>c(H+)>c(OH-) | |
| C. | ②点所示溶液中:2c(Na+)=c(HA)+c(A-) | |
| D. | ③点所示滴入的NaOH溶液的体积V>20.00 mL |
14.下列变化不属于化学变化的是( )
| A. | 石油分馏 | B. | 煤的干馏 | C. | 钢铁生锈 | D. | 煤的液化 |
4.下列金属矿物的冶炼需要采用电解法的是( )
| A. | HgO | B. | Fe2O3 | C. | Al2O3 | D. | Ag2O |
11.下列实验方法能达到实验目的是( )
| A. | 用排水集气法收集氨气 | |
| B. | 用分液漏斗分离水与乙醇的混合物 | |
| C. | 用淀粉溶液检验溶液中是否存在碘单质 | |
| D. | 用氯化钡溶液鉴别碳酸钠溶液与硫酸钠溶液 |
8.用铁片与稀硫酸反应制取氢气时,下列措施不能使反应速率加快的是( )
| A. | 不用稀硫酸,改用98%浓硫酸 | B. | 加热 | ||
| C. | 滴加少量CuSO4溶液 | D. | 不用铁片,改用铁粉 |
9.下列能为人体提供能量的营养物质中,属于高分子化合物的是( )
| A. | 蔗糖 | B. | 油脂 | C. | 葡萄糖 | D. | 蛋白质 |
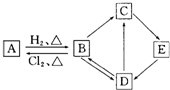 图中的每一方格表示相关的一种反应物或生成物.其中B是一种单质,其余物质也都是有B元素的化合物.C是一种钠盐,E是C的对应的酸,B的结构类似金刚石,D为B的氧化物(其他不含B元素的反应产物以及各步反应添加的必要试剂和反应条件已被略去),请填写空白:
图中的每一方格表示相关的一种反应物或生成物.其中B是一种单质,其余物质也都是有B元素的化合物.C是一种钠盐,E是C的对应的酸,B的结构类似金刚石,D为B的氧化物(其他不含B元素的反应产物以及各步反应添加的必要试剂和反应条件已被略去),请填写空白: