题目内容
15.利用所学习的化学知识回答下面问题:(1)H2O2的电子式

(2)将碳酸氢钠溶液与氯化铝溶液混合,是泡沫灭火器的反应原理.写出该反应的离子反应方程式:Al3++3HCO3-=Al(OH)3↓+3CO2↑.
(3)将NH3通过灼热的CuO,有无色无味的难溶于水的气体生成,该反应中氧化剂和还原剂物质的量之比为:3:2.
(4)常温下,0.1mol•L-1NaHB溶液的PH=4,该溶液中离子浓度由大到小的顺序为c(Na+)>c(HB-)>c(H+)>c(B2-)>c(OH-).
分析 (1)双氧水中两个氢原子分别与两个氧原子通过共用一对电子结合,两个氧原子之间通过共用1对电子结合;
(2)铝离子和碳酸氢根发生相互促进水解反应,生成氢氧化铝沉淀和二氧化碳气体;
(3)将NH3通过灼热的CuO,有无色无味的难溶于水的气体生成,是氨气的还原性被氧化铜氧化生成氮气和水,其中氨气做还原剂,氧化铜做氧化剂;
(4)0.lmol/L pH为4的NaHB溶液,溶液显示酸性,说明HB-的电离程度大于其水解程度,据此分析.
解答 解:(1)双氧水为共价化合物,分子中存在两个氧氢键和一个O-O键,双氧水的电子式为: ,故答案为:
,故答案为: ;
;
(2)氯化铝溶液与碳酸氢钠溶液混合,相互促进水解生成沉淀和气体,则反应的离子方程式为Al3++3HCO3-=Al(OH)3↓+3CO2↑,
故答案为:Al3++3HCO3-=Al(OH)3↓+3CO2↑;
(3)将NH3通过灼热的CuO,有无色无味的难溶于水的气体生成,是氨气的还原性被氧化铜氧化生成氮气和水,反应的化学方程式为:2NH3+3CuO$\frac{\underline{\;\;△\;\;}}{\;}$3Cu+N2+3H2O,其中氧化铜做氧化剂,物质的量为3mol,氨气做还原剂,物质的量为2mol,故氧化剂和还原剂的物质的量之比为3:2,故答案为:3:2;
(4)0.lmol/L pH为4的NaHB溶液显示酸性,则c(H+)>c(OH-),说明HB-的电离程度大于其水解程度,则c(H2B)<c(B2-),溶液中离子浓度大小为:c(Na+)>c(HB-)>c(H+)>c(B2-)>c(OH-),故答案为:c(Na+)>c(HB-)>c(H+)>c(B2-)>c(OH-).
点评 本题考查了常见物质的电子式的书写、反应方程式的书写以及离子浓度的大小比较,难度不大,应注意基础的掌握.

 阅读快车系列答案
阅读快车系列答案| A. | 硅酸钠属于盐,不属于碱,所以硅酸钠可以保存在磨口玻璃塞试剂瓶中 | |
| B. | 反应①Na2SiO3+H2O+CO2═Na2CO3+H2SiO3↓,反应②Na2CO3+SiO2$\frac{\underline{\;高温\;}}{\;}$NaSiO3+CO2↑,两反应是相互矛盾的,不可能都发生 | |
| C. | 普通玻璃、石英玻璃、水泥等均属于硅酸盐材料 | |
| D. | 祖母绿的主要成分为Be3Al2Si6O18,用氧化物形式表示为3BeO•Al2O3•6SiO2 |
| A. | 等物质的量的CaCl2和CaO2含有的离子数 | |
| B. | 等质量的水与重水含有的电子数 | |
| C. | 同温、同压同体积的CO和NO含有的质子数 | |
| D. | 等物质的量的铁和铝分别与足量氯气完全反应时转移的电子数 |
①漏斗 ②蒸发皿 ③托盘天平 ④分液漏斗 ⑤蒸馏烧瓶 ⑥量筒 ⑦燃烧匙.
| A. | ①②⑤⑥ | B. | ①②④⑤ | C. | ②③⑤⑥ | D. | ③④⑥⑦ |

| A. | ①点所示溶液中:c(A-)+c(OH-)=c(HA)+c(H+) | |
| B. | ②点所示溶液中:c(Na+)>c(HA)>c(A-)>c(H+)>c(OH-) | |
| C. | ②点所示溶液中:2c(Na+)=c(HA)+c(A-) | |
| D. | ③点所示滴入的NaOH溶液的体积V>20.00 mL |
| A. | HgO | B. | Fe2O3 | C. | Al2O3 | D. | Ag2O |
| A. | 酒精 | B. | 汽油 | C. | 柴油 | D. | 液化石油气 |

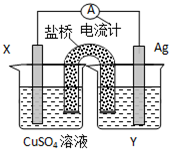 依据氧化还原反应:2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)设计的原电池如图所示:
依据氧化还原反应:2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)设计的原电池如图所示: