题目内容
5.为探究锌与稀硫酸的反应速率[ν(H2)],向反应混合液中加入某些物质,下列判断正确的是( )| A. | 加入NaHSO4固体,ν(H2)不变 | B. | 加入少量水,ν(H2)减小 | ||
| C. | 加入CH3COONa固体,ν(H2)不变 | D. | 滴加少量CuSO4溶液,ν(H2)减小 |
分析 锌为固体,与稀硫酸反应时,固体的表面积越大,溶液浓度越大或温度越高,以及形成原电池反应都可增大反应速率,以此解答.
解答 解:A.加入NaHSO4固体,溶液中c(H+)增大,反应速率加快,即v(H2)增大,故A错误;
B.加入水,溶液中c(H+)减小,反应速率减小,故B正确;
C.加入CH3COONa固体,溶液中c(H+)减小,反应速率减小,故C错误;
D.滴加少量CuSO4溶液,Zn置换出Cu,构成原电池,加快反应速率,故v(H2)增大,故D错误.
故选B.
点评 本题考查反应速率的影响因素,为高频考点,侧重于学生的分析能力和基本理论知识的综合理解和运用的考查,注意把握相关基础知识的积累,难度不大.

练习册系列答案
相关题目
6.化学与生活息息相关,以下说法不正确的是( )
| A. | 集中处理废旧电池,以防止重金属污染环境 | |
| B. | 海产品中加入大量甲醛以延长保鲜期 | |
| C. | 食用蔬菜水果可以补充人体所需维生素 | |
| D. | 使用加碘盐,可预防因缺碘引起的甲状腺肿大 |
16.现有五种元素,其中A、B、C为短周期主族元素,D、E为第四周期元素,它们的原子序数依次增大.请根据下列相关信息,回答问题.
(1)A基态原子中能量最高的电子,其电子云在空间有3个方向,原子轨道呈纺锤形形.
(2)E在周期表的位置是第四周期第IB族,位于ds区,其基态原子有29种运动状态.
(3)BC3中心原子的杂化方式为sp3,用价层电子对互斥理论推测其分子空间构型为三角锥形,检验D元素的方法是焰色反应.
(4)E单质晶体中原子的堆积方式如图甲所示,其晶胞特征如图乙所示.则晶胞中该原子的配位数为12,E单质晶体中原子的堆积方式为四种基本堆积方式中的面心立方堆积.若已知E的原子半径为d cm,NA代表阿伏加德罗常数,E的相对原子质量为M,则该晶体的密度为$\frac{M}{4\sqrt{2}{d}^{3}{N}_{A}}$g•cm-3(用字母表示).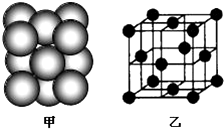
| A元素原子的核外p电子总数比s电子总数少1 |
| B原子核外所有p轨道全满或半满 |
| C元素的主族序数与周期数的差为4 |
| D是前四周期中电负性最小的元素 |
| E在周期表的第十一列 |
(2)E在周期表的位置是第四周期第IB族,位于ds区,其基态原子有29种运动状态.
(3)BC3中心原子的杂化方式为sp3,用价层电子对互斥理论推测其分子空间构型为三角锥形,检验D元素的方法是焰色反应.
(4)E单质晶体中原子的堆积方式如图甲所示,其晶胞特征如图乙所示.则晶胞中该原子的配位数为12,E单质晶体中原子的堆积方式为四种基本堆积方式中的面心立方堆积.若已知E的原子半径为d cm,NA代表阿伏加德罗常数,E的相对原子质量为M,则该晶体的密度为$\frac{M}{4\sqrt{2}{d}^{3}{N}_{A}}$g•cm-3(用字母表示).

20.我国科学家在世界上首次合成三种新核素,其中一种新核素的名称是铪-185,关于铪-185,下列说法中正确的是( )
①是一种新元素 ②是一种新原子 ③原子核内有185个质子 ④是铪-180的一种新的核素.
①是一种新元素 ②是一种新原子 ③原子核内有185个质子 ④是铪-180的一种新的核素.
| A. | ①和③ | B. | ②和④ | C. | ②和③ | D. | ③和④ |
10.下列指定微粒的数目相等的是( )
| A. | 等物质的量的CaCl2和CaO2含有的离子数 | |
| B. | 等质量的水与重水含有的电子数 | |
| C. | 同温、同压同体积的CO和NO含有的质子数 | |
| D. | 等物质的量的铁和铝分别与足量氯气完全反应时转移的电子数 |
14.下列变化不属于化学变化的是( )
| A. | 石油分馏 | B. | 煤的干馏 | C. | 钢铁生锈 | D. | 煤的液化 |
 和
和