题目内容
2.下列叙述中正确的是( )| A. | 化学反应过程中,旧键断裂放出能量,新键生成吸收能量 | |
| B. | 常温下,任何酸、碱间反应,每生成1mol水时的中和热都相同 | |
| C. | 放热反应在常温下都能自发进行 | |
| D. | 升高温度使活化分子百分数增大,反应速率增大 |
分析 A.断裂化学键吸收能量;
B.弱酸、弱碱的电离吸热,浓硫酸稀释放热;
C.放热反应与反应条件无关;
D.升高温度,提供能量,单位体积内活化分子百分数增大.
解答 解:A.化学反应过程中,旧键断裂吸收能量,新键生成释放能量,故A错误;
B.弱酸、弱碱的电离吸热,浓硫酸稀释放热,而稀的强酸、强碱反应生成1mol水时的中和热都相同,故B错误;
C.放热反应与反应条件无关,如燃烧反应为放热反应,需要加热或点燃,常温不反应,故C错误;
D.升高温度,提供能量,单位体积内活化分子百分数增大,有效碰撞的机会增大,反应速率增大,故D正确;
故选D.
点评 本题考查反应热与焓变,为高频考点,把握反应中能量变化、反应条件与反应热等为解答的关键,侧重分析与应用能力的考查,综合性较强,题目难度不大.

练习册系列答案
相关题目
8.某同学利用如图装置探究SO2的性质.
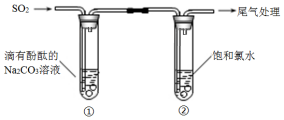
下列有关反应的方程式,不正确的是( )

下列有关反应的方程式,不正确的是( )
| A. | ①中溶液显红色的原因:CO32-+H2O?HCO3-+OH- | |
| B. | ①中溶液红色褪去的原因:2SO2+CO32-+H2O═CO2+2HSO3- | |
| C. | ②中溶液显黄绿色的原因:Cl2+H2O═HCl+HClO | |
| D. | ②中溶液黄绿色褪去的原因:SO2+Cl2+2H2O═H2SO4+2HCl |
9.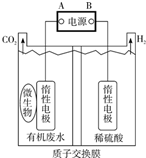 在微生物作用下电解有机废水(含CH3COOH),可获得清洁能源H2,其原理如图所示,下列有关说法不正确的是( )
在微生物作用下电解有机废水(含CH3COOH),可获得清洁能源H2,其原理如图所示,下列有关说法不正确的是( )
 在微生物作用下电解有机废水(含CH3COOH),可获得清洁能源H2,其原理如图所示,下列有关说法不正确的是( )
在微生物作用下电解有机废水(含CH3COOH),可获得清洁能源H2,其原理如图所示,下列有关说法不正确的是( )| A. | 电极B极为负极 | |
| B. | 与电源A极相连的惰性电极上发生的反应为:CH3COOH-8e-+H2O=2CO2↑+8H+ | |
| C. | 通电后,H+通过质子交换膜向右移动,最终右侧溶液pH减小 | |
| D. | 通电后,若有0.1molH2生成,则转移0.2mol电子 |
6.HClO属于( )
| A. | 电解质 | B. | 非电解质 | C. | 强酸 | D. | 氧化物 |
13.绿原酸是从金银花中提取出的有很高药用价值的有机物,其结构如图所示,下列说法正确的是( )
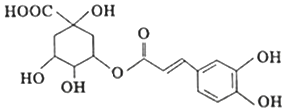

| A. | 绿原酸分子中有4种含氧官能团 | |
| B. | 绿原酸能发生取代、加成、消去和氧化反应 | |
| C. | 绿原酸在酸性条件下的水解产物均能与FeCl3发生显色反应 | |
| D. | l mol绿原酸与足量钠反应,可生成4 molH2 |
14.利用如图所示装置可制取 H2,两个电极均为惰性电极,c 为阴离子交换膜.下列叙述正确的是( )

| A. | a 为电源的正极 | |
| B. | 工作时,OH-向左室迁移 | |
| C. | 右室电极反应为:C2H5OH+H2O-4e-═CH3COO-+5H+ | |
| D. | 生成 H2 和 CH3COONa 的物质的量之比为 2:1 |
11.下列关于有机化合物的说法正确的是( )
| A. | 1mol的  与足量的NaOH溶液反应,能消耗3mol NaOH 与足量的NaOH溶液反应,能消耗3mol NaOH | |
| B. | 可用氢氧化钠溶液除去乙酸乙酯中残留的乙酸 | |
| C. | 间二甲苯也叫1,5-二甲苯 | |
| D. | 乙二醇和丙三醇互为同系物 |
12.下列离子反应方程式正确的是( )
| A. | 少量二氧化碳通入“水玻璃”中:CO2+SiO32-+H2O═CO32-+H2SiO3↓ | |
| B. | 碳酸钙与稀盐酸混合:CO32-+2H+═CO2↑+H2O | |
| C. | 铁粉加入稀硫酸中:2Fe+6H+═2Fe3++3H2↑ | |
| D. | Al2O3溶于NaOH溶液中:Al2O3+2OH-═2[Al(OH)4]- |
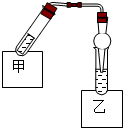 如图是乙酸乙酯制备的装置.在试管甲中先加入2mL 95%的乙醇,并在摇动下缓缓加入2mL浓硫酸,充分摇匀,冷却后再加入2g无水乙酸钠,用玻璃棒充分搅拌后将试管固定在铁架台上.
如图是乙酸乙酯制备的装置.在试管甲中先加入2mL 95%的乙醇,并在摇动下缓缓加入2mL浓硫酸,充分摇匀,冷却后再加入2g无水乙酸钠,用玻璃棒充分搅拌后将试管固定在铁架台上.