题目内容
15.下列实验装置、操作能达到实验目的是( )| A. |  测定中和热 | B. |  反应快慢 | C. |  粗铜的电解精炼 | D. |  电解食盐水 |
分析 A.温度计用于测量反应液的温度;
B.锌置换出铜,形成原电池反应,反应较快;
C.精炼铜,粗铜为阳极,纯铜为阴极;
D.电解饱和食盐水,用惰性电极.
解答 解:A.温度计用于测量反应液的温度,应掺入小烧杯内,故A错误;
B.锌为活泼金属,与酸反应的实质为锌与氢离子反应,左侧烧杯内锌置换出铜,形成原电池反应,反应较快,滴加硫酸铜溶液的烧杯反应较快,故B错误;
C.精炼铜,粗铜为阳极,纯铜为阴极,在阴极析出铜,故C错误;
D.电解饱和食盐水,用惰性电极,题中装置符合要求,故D正确.
故选D.
点评 本题考查化学实验方案评价,为高频考点,涉及金中和热的测定、原电池与电解池等知识点,把握实验操作的规范性、实验细节和实验原理为解答的关键,注意方案的合理性、评价性、操作性分析,难度不大.

练习册系列答案
 全能练考卷系列答案
全能练考卷系列答案 一课一练课时达标系列答案
一课一练课时达标系列答案
相关题目
3.只有一种试剂可区别Na2SO4、MgCl2、FeCl2、Al2(SO4)3、(NH4)2SO4五种溶液,这种试剂是( )
| A. | AgNO3 | B. | H2SO4 | C. | NaOH | D. | Ba(OH)2 |
10.设NA表示阿伏加德罗常数.下列说法正确的是( )
| A. | 标准状况下,11.2L N2O4中含有的分子数目为0.5NA | |
| B. | 常温常压下,10.4g苯乙烯中含有的碳碳双键数目为0.1NA | |
| C. | 标准状况下,0.1mol Cl2溶于水,转移的电子数目为0.1NA | |
| D. | 常温常压下,0.1mol单质硅和二氧化硅中含有的共价键数目都是0.2NA |
20.甲烷中混有乙烯,欲除去乙烯得到纯净的甲烷,最好依次通过盛有以下哪种试剂的洗气瓶( )
| A. | 澄清石灰水,浓H2SO4 | B. | 酸性KMnO4溶液,浓H2SO4 | ||
| C. | 溴水,烧碱溶液,浓硫酸 | D. | 浓H2SO4,酸性KMnO4溶液 |
 将等径圆球在二维空间里进行排列,可形成密置层和非密置层,在图1所示的半径相等的圆球的排列中,A属于非密置层,配位数是4.
将等径圆球在二维空间里进行排列,可形成密置层和非密置层,在图1所示的半径相等的圆球的排列中,A属于非密置层,配位数是4.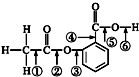 阿司匹林的结构简式如图,①②③④⑤⑥分别标出了其分子中不同的键.请判断阿司匹林与乙醇发生反应时,断键的位置是( )
阿司匹林的结构简式如图,①②③④⑤⑥分别标出了其分子中不同的键.请判断阿司匹林与乙醇发生反应时,断键的位置是( )
 ,并推测1mol NH4BF4(氟硼酸铵)中含有2NA个配位键.
,并推测1mol NH4BF4(氟硼酸铵)中含有2NA个配位键.