题目内容
4.某有机化合物M,其分子式为AxByCz,且x+y+z=22,己知M放入水中即与水发生复分解反应生成白色沉淀E和无色气体F.白色沉淀水E不溶于氨水,能溶于氢氧化钠溶液,取0.1mol M放入足量水中,能收集到9g气体F.将该气体在空气中完全燃烧,只生成26.4g二氧化碳和16.2g水.求:(1)气体F的分子式;
(2)有机化合物M的分子式;
(3)写出M与过量的氢氧化钠溶液反应的化学方程式.
分析 n(CO2)=$\frac{26.4g}{44g/mol}$=0.6mol,n(H2O)=$\frac{16.2g}{18g/mol}$=0.9mol,可计算n(C):n(H),确定有机物F的分子式,白色沉淀E不溶于氨水,能溶于氢氧化钠溶液,所以E是氢氧化铝,即M中含有铝元素,结合x+y+z=22,可确定M,以此解答该题.
解答 解:(1)n(CO2)=$\frac{26.4g}{44g/mol}$=0.6mol,n(H2O)=$\frac{16.2g}{18g/mol}$=0.9mol,则n(C):n(H)=0.6mol:0.9mol×2=1:3,则F应为C2H6,为乙烷,
答:气体F的分子式为C2H6;
(2)9g乙烷是0.3mol,M是0.1mol,因此M中含有6个碳原子.
白色沉淀E不溶于氨水,能溶于氢氧化钠溶液,所以E是氢氧化铝,即M中含有铝元素.
因此x+z=16、3x+z=6×3,
解得x=1,z=15
所以M的化学式为Al(C2H5)3或AlC6H15,
答:有机化合物M的分子式为Al(C2H5)3或AlC6H15;
(3)由于氢氧化铝是两性氢氧化物,能溶解在氢氧化钠中,所以方程式为Al(C2H5)3+NaOH+H2O=NaAlO2+3CH3CH3↑或Al(C2H5)3+3H2O=Al(OH)3↓+3CH3CH3↑,Al(OH)3+NaOH=NaAlO2+2H2O,
答:M与过量的氢氧化钠溶液反应的化学方程式为Al(C2H5)3+NaOH+H2O=NaAlO2+3CH3CH3↑或Al(C2H5)3+3H2O=Al(OH)3↓+3CH3CH3↑,Al(OH)3+NaOH=NaAlO2+2H2O.
点评 本题考查有机物的推断,为高频考点,侧重于学生的分析、计算能力的考查,注意把握物质的性质以及有机物分子式确定的思路、方法,难度不大.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 发酵粉就是NaHCO3,使用它可使生产的食品疏松可口 | |
| B. | 燃煤中添加适量的CaO,有利于降低酸雨形成的概率 | |
| C. | 放置较久的红薯比新挖出土的甜,可能与葡萄糖的水解有关 | |
| D. | 用液溴来吸收香蕉产生的乙烯,达到保鲜的目的 |
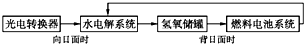 如图所示是某太空空间站能量转化系统的局部示意图,其中燃料电池采用KOH溶液为电解液,下列有关说法中正确的是( )
如图所示是某太空空间站能量转化系统的局部示意图,其中燃料电池采用KOH溶液为电解液,下列有关说法中正确的是( )| A. | 该能量转化系统工作时,需不断补充H2O | |
| B. | 该转化系统的能量本质上来源于太阳能 | |
| C. | 水电解系统中的阴极反应:O2+2H2O+4e-═4OH- | |
| D. | 燃料电池放电时的负极反应:H2-2e-═2H+ |
| A. | 常温下,将pH=10的氨水溶液稀释到原体积的10倍后,溶液的pH=9 | |
| B. | 25℃时,分别向体积均为10mL pH=3的HCl和pH=3的CH3COOH溶液中,滴加0.1mol•L-1的NaOH溶液,至中性时,盐酸消耗的氢氧化钠体积多 | |
| C. | 向0.05mol•L-1的Na2CO3溶液中加入0.05mol CaO,溶液中$\frac{c(O{H}^{-})}{c(HC{{O}_{3}}^{-})}$减小 | |
| D. | 25℃时氯气-氯水体系汇总存在以下平衡关系:c(H+)-c(OH-)=2c(ClO-)+c(HClO) |
| A. | 邻二甲苯、间二甲苯、对二甲苯沸点依次减小 | |
| B. | 蛋白质溶液加双缩脉试剂会显紫玫瑰色,与茚三酮溶液共热会显蓝紫色,与浓硝酸微热会产生黄色固体 | |
| C. | 在有机物 中至少有14个原子共平面 中至少有14个原子共平面 | |
| D. | 1.0mol 最多能与含3.0mol NaOH的水溶液完全反应 最多能与含3.0mol NaOH的水溶液完全反应 |
| A. | KAl(SO4)2•12H2O不属于配合物 | |
| B. | 配位化合物中的配体可以是分子也可以是阴离子 | |
| C. | 配位数为4的配合物均为正四面体结构 | |
| D. | 已知[Cu(NH3)2]2+的空间构型为直线型,则它的中心原子采用sp杂化 |