题目内容
4.下列各物质是中学化学中常见的物质,甲为常见金属单质,乙、丙、丁是非金属单质,其它为化合物,B、D分别为黑色粉末和黑色晶体,G为淡黄色固体,J为生活中常见的调味品,I为红褐色固体,①是实验室制取丁的反应之一,F为棕黄色溶液.各物质间的转化如下图所示,回答下列各问题(部分生成物未列出):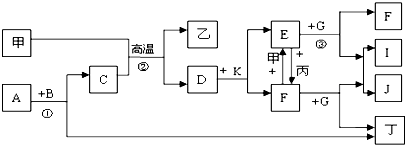
(1)写出乙的化学式H2、A的电子式
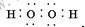 、甲在周期表中位置是第四周期第Ⅷ族;
、甲在周期表中位置是第四周期第Ⅷ族;(2)写出G的一种用途供氧剂等;
(3)写出B与K的浓溶液反应的化学方程式:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ MnCl2+Cl2↑+2H2O;
(4)整个转换过程中属于氧化还原反应的数目有6个;
(5)写出反应③E与A按物质的量之比2:1的反应的离子方程式6Fe2++3H2O2═4Fe3++2Fe(OH)3↓.
分析 G为淡黄色固体化合物,J为生活中常见的调味品,则G是Na2O2,一般考虑J为NaCl;I为红褐色固体,则I是氢氧化铁;所以判断甲是Fe单质;B、D分别为黑色粉末和黑色晶体,Fe与物质C发生置换反应生成另一种非金属单质,根据Fe与水蒸气的反应生成氢气和黑色固体四氧化三铁,所以C是水,乙是氢气,D是Fe3O4;A与B反应生成水和一种非金属单质,判断A是过氧化氢,B是二氧化锰,二者反应生成水和氧气,所以丁是氧气;四氧化三铁与K反应生成两种物质E、F,可以相互转化,所以K是盐酸,与四氧化三铁反应生成氯化亚铁和氯化铁,F与Fe反应生成E,所以F是氯化铁,则E是氯化亚铁,氯化铁与过氧化钠反应生成氢氧化铁、氯化钠、氧气,氯化亚铁与一定量的过氧化钠反应生成氯化铁、氢氧化铁、氯化钠.
解答 解:G为淡黄色固体化合物,J为生活中常见的调味品,则G是Na2O2,一般考虑J为NaCl;I为红褐色固体,则I是氢氧化铁;所以判断甲是Fe单质;B、D分别为黑色粉末和黑色晶体,Fe与物质C发生置换反应生成另一种非金属单质,根据Fe与水蒸气的反应生成氢气和黑色固体四氧化三铁,所以C是水,乙是氢气,D是Fe3O4;A与B反应生成水和一种非金属单质,判断A是过氧化氢,B是二氧化锰,二者反应生成水和氧气,所以丁是氧气;四氧化三铁与K反应生成两种物质E、F,可以相互转化,所以K是盐酸,与四氧化三铁反应生成氯化亚铁和氯化铁,F与Fe反应生成E,所以F是氯化铁,则E是氯化亚铁,氯化铁与过氧化钠反应生成氢氧化铁、氯化钠、氧气,氯化亚铁与一定量的过氧化钠反应生成氯化铁、氢氧化铁、氯化钠.
(1)根据以上分析,乙的化学式是H2;过氧化氢的电子式是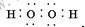 ;Fe位于元素周期表中的第四周期第Ⅷ族,
;Fe位于元素周期表中的第四周期第Ⅷ族,
故答案为:H2;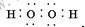 ;第四周期第Ⅷ族;
;第四周期第Ⅷ族;
(2)过氧化钠可与二氧化碳反应生成氧气,所以过氧化钠可作供氧剂,
故答案为:供氧剂等;
(3)二氧化锰与浓盐酸加热反应生成氯化锰、氯气、水,是实验室制取氯气的反应,化学方程式是:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ MnCl2+Cl2↑+2H2O,
故答案为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ MnCl2+Cl2↑+2H2O;
(4)转化中除D与K的反应不是氧化还原反应外,其余均是氧化还原反应,共6个,故答案为:6;
(5)氯化亚铁与过氧化氢按物质的量之比2:1反应,则生成氢氧化铁沉淀和铁离子,离子方程式是6Fe2++3H2O2═4Fe3++2Fe(OH)3↓,
故答案为:6Fe2++3H2O2═4Fe3++2Fe(OH)3↓.
点评 本题考查无机推断、物质化学性质的应用、离子方程式的书写,注意根据物质的性质、特征作为突破口进行推断,学习中注意牢固把握元素化合物的性质.

| A. | 质子数为8、中子数为10的氧原子:$\stackrel{18}{8}$O | |
| B. | 氧原子的结构示意图: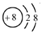 | |
| C. | 水分子的电子式: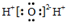 | |
| D. | 乙醛的结构简式:CH3COH |
| A. | 邻二甲苯、间二甲苯、对二甲苯沸点依次减小 | |
| B. | 蛋白质溶液加双缩脉试剂会显紫玫瑰色,与茚三酮溶液共热会显蓝紫色,与浓硝酸微热会产生黄色固体 | |
| C. | 在有机物 中至少有14个原子共平面 中至少有14个原子共平面 | |
| D. | 1.0mol 最多能与含3.0mol NaOH的水溶液完全反应 最多能与含3.0mol NaOH的水溶液完全反应 |
| A. | Al--Al2O3--Al(OH)3--Na[Al(OH)4] | B. | Mg--MgCl2--Mg(OH)2--MgO | ||
| C. | S--SO3--H2SO4--MgSO4 | D. | Si--SiO2--H2SiO3--Na2SiO3 |
| A. | 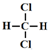 和 和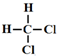 | B. | CH2=CH-CH=CH2和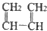 | ||
| C. | C(CH3)3C(CH3)3和CH3(CH2)3C(CH3)3 | D. | 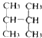 和 和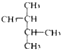 |
| A. | ⅡA族元素的阳离子与上周期稀有气体元素的原子具有相同的核外电子排布 | |
| B. | 元素周期表中从ⅢB族到ⅡB族10个纵行的元素都是金属元素 | |
| C. | 多电子原子中,在离核较近的区域内运动的电子能量较低 | |
| D. | 两个非金属元素原子间只可能形成共价键,而含金属元素的化合物中一定含离子键 |
| A. | 烧碱 石灰石 石英 | B. | 纯碱 石灰石 石英 | ||
| C. | 纯碱 生石灰 石英 | D. | 纯碱 熟石灰 石英 |