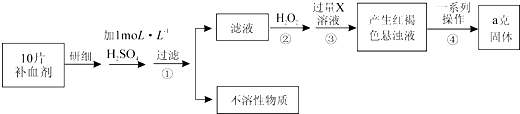
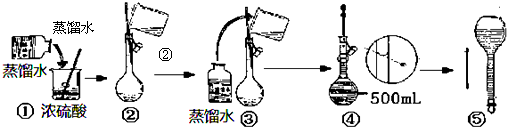
题目内容
9.用价层电子对互斥理论预测H2S和CH2O分子的立体结构,两个结论都正确的是( )| A. | 直线形;平面三角形 | B. | V形;三角锥形 | ||
| C. | 直线形;三角锥形 | D. | V形;平面三角形 |
分析 分子中中心原子价层电子对数=σ键数+孤电子对数,如果价层电子对数是4且不含孤电子对,则为正四面体结构,如果价层电子对数是4且含有一个孤电子对,则为三角锥形结构,如果价电子对个数是4且含有2个孤电子对,则为V形,若价层电子对数为3,不含孤电子对,则为平面三角形,若有1对孤电子对,则为角形.
解答 解:H2S中S原子孤电子对数为$\frac{6-2}{2}$=2,价层电子对数为2+2=4,故为V形结构,而CH2O中C原子故电子对数为$\frac{4-2-1×2}{2}$=0,价层电子对数为3+0=3,故其为平面三角形结构,
故选:D.
点评 本题考查了分子空间构型的判断,据价层电子对互斥理论分析解答即可,注意孤电子对个数的计算方法.

练习册系列答案
 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案
相关题目
20.下列有关说法错误的是( )
| A. | 室温下的某 NaF 溶液中,c(H+)=1×10-10 mol?L-1,说明 NaF 使水的电离减弱 | |
| B. | Mg 在空气中燃烧时发出耀眼的白光,一部分化学能转化为光能 | |
| C. | 纯碱溶于热水中去污效果增强,说明纯碱的水解是吸热反应 | |
| D. | 反应 N2(g)+3H2(g)═2NH3(g)(△H<0)达平衡后,降低温度,正、逆反应速率都减小,平衡向正反应方向移动 |
17.化学反应中一定伴随着能量的变化,下列有关能量的说法正确的是( )
| A. | 等物质的量的硫蒸气和硫粉分别完全燃烧,后者放出热量多 | |
| B. | 由C(石墨)═C(金刚石)-1.9KJ可知,金刚石比石墨稳定 | |
| C. | 根据热化学方程式:S(s)+O2(g)═SO2(g)+297.23 kJ,可推知1 mol SO2 (g)的能量总和大于1 mo S(s)和1 mol O2(g)的能量总和 | |
| D. | 在稀水溶液中 H+(aq)+OH-(aq)═H2O(l)+57.3 kJ,将含0.5 mol H2SO4的浓硫酸与含l mol NaOH的溶液混合时,放出的热量大于57.3 kJ |
4.下列各项中表达正确的是( )
| A. | H、D、T表示同一种核素 | B. | 次氯酸电子式 | ||
| C. | F原子结构示意图: | D. | CH4分子的球棍模型: |
18.下列说法错误的是( )
| A. | 钢铁发生析氢腐蚀时,负极电极反应是Fe-2e-=Fe2+ | |
| B. | 根据盖斯定律,可计算某些难以直接测定的反应焓变 | |
| C. | 增大压强不能降低活化能,但能增加活化分子百分数 | |
| D. | 一定温度下,反应MgCl2(l)=Mg(l)+Cl2(g)的△H>0△S>0 |
19.下列方法中不宜用浓HNO3作试剂的是( )
| A. | 判断黄金首饰中是否掺有铜 | B. | 实验室制取二氧化碳 | ||
| C. | 除去镀在铝表面的铜镀层 | D. | 配制溶解金的王水 |
 如图为某有机物的质谱图,测得其含碳量为76.6%,含氢量为6.4%,其余为氧元素.
如图为某有机物的质谱图,测得其含碳量为76.6%,含氢量为6.4%,其余为氧元素. ;
; +3HBr;
+3HBr; +H2O.
+H2O.