题目内容
19.(1)0.5mol NH3分子中所含氮原子数为3.01×1023个(2)2.3g Na中含电子的物质的量为1.1mol,在跟足量水反应中失去电子的物质的量为0.1mol.
(3)2mol O3和3mol O2的质量之比为1:1,原子数之比为1:1,同温同压下体积之比为2:3.
分析 (1)氮原子物质的量等于氨气物质的量,根据N=nNA计算N原子数目;
(2)根据n=$\frac{m}{M}$计算Na的物质的量,含有电子物质的量为钠的11倍,Na与水反应生成NaOH与氢气,结合Na元素化合价变化计算失去电子;
(3)根据m=nM计算二者质量之比,结合分子式计算氧原子数目之比,同温同压下气体的体积之比等于其物质的量之比.
解答 解:(1)0.5mol NH3分子中所含氮原子数为:0.5mol×6.02×1023mol-1=3.01×1023,
故答案为:3.01×1023;
(2)2.3g Na的物质的量为$\frac{2.3g}{23g/mol}$=0.1mol,含有电子物质的量为0.1mol×11=1.1mol,Na与水反应生成NaOH与氢气,反应中Na失去电子为0.1mol×1=0.1mol,
故答案为:1.1;0.1;
(3)2mol O3和3mol O2的质量之比为2mol×48g/mol:3mol×32g/mol=1:1,含有原子数之比为2mol×3:3mol×2=1:1,同温同压下体积之比为2mol:3mol=2:3,
故答案为:1:1;1:1;2:3.
点评 本题考查物质的量有关计算,比较基础,注意对公式的理解与灵活应用.

练习册系列答案
 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案
相关题目
10.下列物质中,既能与盐酸反应又能与NaOH溶液反应的是( )
①NaHCO3,②Al2O3,③Al(OH)3,④Na2CO3,⑤Al.
①NaHCO3,②Al2O3,③Al(OH)3,④Na2CO3,⑤Al.
| A. | ②③ | B. | ②③④ | C. | ①②③⑤ | D. | 全部 |
7.某溶液中FeCl3与FeCl2物质的量之比为1:1,当向溶液中加入足量铁粉并充分反应,所得溶液中Fe2+和Cl-物质的量浓度之比为( )
| A. | 2:3 | B. | 3:5 | C. | 1:2 | D. | 1:1 |
8.下列物质属于纯净物的是( )
| A. | 漂白粉 | B. | 水玻璃 | C. | 苏打 | D. | 碱石灰 |
9.用价层电子对互斥理论预测H2S和CH2O分子的立体结构,两个结论都正确的是( )
| A. | 直线形;平面三角形 | B. | V形;三角锥形 | ||
| C. | 直线形;三角锥形 | D. | V形;平面三角形 |
 短周期元素T、Q、R、W、Z在元素周期表中的位置如右图所示,其中T所处的周期序数与主族序数相等,请回答下列问题:
短周期元素T、Q、R、W、Z在元素周期表中的位置如右图所示,其中T所处的周期序数与主族序数相等,请回答下列问题: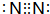
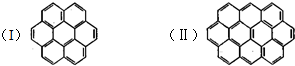 有两个或两个以上的苯环以共有环边的方式相互稠合的多环芳香烃称为稠环芳香烃.下图中椭圆烯也属于稠环芳香烃.据此回答:
有两个或两个以上的苯环以共有环边的方式相互稠合的多环芳香烃称为稠环芳香烃.下图中椭圆烯也属于稠环芳香烃.据此回答: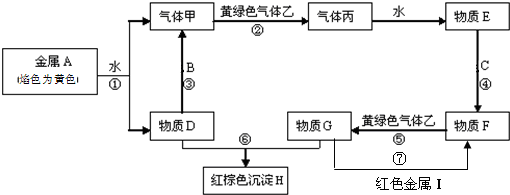
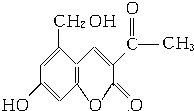 它配以辅料丙二醇溶成针剂用于临床.假药中使用廉价的二甘醇作为辅料,二甘醇为工业溶剂,有很强的毒性.请回答下列问题:
它配以辅料丙二醇溶成针剂用于临床.假药中使用廉价的二甘醇作为辅料,二甘醇为工业溶剂,有很强的毒性.请回答下列问题: .
.