题目内容
6.反应A(g)+B(g)?2C(g);△H<0,达到平衡时,下列说法正确的是( )| A. | 其他条件不变,减小容器体积,平衡不移动 | |
| B. | 其他条件不变,增大c(A),A的转化率增大 | |
| C. | 降低温度,v正增大,v逆减小 | |
| D. | v正(A)═2v逆(C) |
分析 A.减小容器体积,压强增大,平衡向气体体积减小的方向进行;
B.化学反应中,两种反应物,增大一种物质的量会提高另一种物质转化率,本身转化率减小;
C.反应是放热反应,降温平衡向放热反应方向进行,反应速率减小,正逆反应速率都减小;
D.反应速率之比等于化学方程式计量数之比,为正反应速率之比,达到平衡状态需要满足正逆反应速率相同;
解答 解:A.反应A(g)+B(g)?2C(g),反应前后是气体体积不变的反应,其他条件不变,减小容器体积,氨气增大平衡不移动,故A正确;
B.其他条件不变,增大c(A),B的转化率增大,A的转化率减小,故B错误;
C.降低温度,化学反应速率减小,正逆反应速率都增大,v正增大,v逆增大,故C错误;
D.化学反应速率之比等于化学方程式计量数之比为正反应速率之比,2v正(A)═v正(C),只有当达到平衡时2v正(A)═v逆(C),C的正逆反应速率相同,说明反应达到平衡状态,v正(A)═2v逆(C),速率之比错误,故D错误;
故选A.
点评 本题考查学生影响化学反应速率和化学平衡移动的因素知识,属于综合知识的考查,难度不大.

练习册系列答案
相关题目
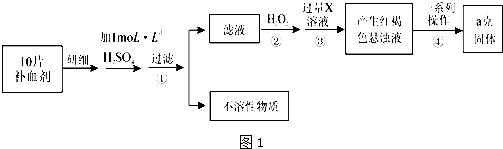
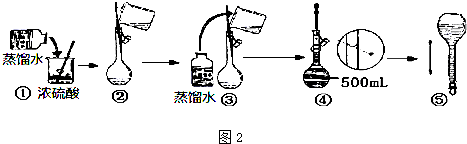
16.实验室用高锰酸钾固体配制0.10mol/L的高锰酸钾溶液500mL,并用该标准液滴定某酸性工业废水中铁元素的含量,请按要求完成实验,并回答相关问题:
I.标准液的配制
(1)所需的实验仪器有烧杯、量筒、玻璃棒,还缺少的玻璃仪器是500mL容量瓶和胶头滴管.
(2)称量所需高锰酸钾固体7.9g,用少量蒸馏水溶解于烧杯中,搅拌,待冷却至室温,转移至容量瓶中,并用50mL蒸馏水洗涤烧杯2~3次,洗涤液也要注入容量中,并摇匀.
(3)若定容时,俯视观察液面,造成所配高锰酸钾溶液浓度偏高(填“偏高”、“偏低”、“不影响”).
II.滴定工业废水中铁元素的含量(全部铁元素以Fe2+形式存在).
(4)在滴定时,每次准确量取待测液25.00ml于锥形瓶中,并加入适量酸酸化后进行滴定,你认为可以加入下面哪种酸C
A.盐酸 B.硝酸 C.硫酸
(5)已知亚铁离子与高锰酸根按照物质的量之比5:1反应,写出酸性条件下滴定反应的离子方程式5Fe2++MnO4-+8H+=Mn2++5Fe3++4H2O.
(6)重复三次滴定,结果记录如下表:计算该工业废水中亚铁离子的浓度为0.2mol/L
I.标准液的配制
(1)所需的实验仪器有烧杯、量筒、玻璃棒,还缺少的玻璃仪器是500mL容量瓶和胶头滴管.
(2)称量所需高锰酸钾固体7.9g,用少量蒸馏水溶解于烧杯中,搅拌,待冷却至室温,转移至容量瓶中,并用50mL蒸馏水洗涤烧杯2~3次,洗涤液也要注入容量中,并摇匀.
(3)若定容时,俯视观察液面,造成所配高锰酸钾溶液浓度偏高(填“偏高”、“偏低”、“不影响”).
II.滴定工业废水中铁元素的含量(全部铁元素以Fe2+形式存在).
(4)在滴定时,每次准确量取待测液25.00ml于锥形瓶中,并加入适量酸酸化后进行滴定,你认为可以加入下面哪种酸C
A.盐酸 B.硝酸 C.硫酸
(5)已知亚铁离子与高锰酸根按照物质的量之比5:1反应,写出酸性条件下滴定反应的离子方程式5Fe2++MnO4-+8H+=Mn2++5Fe3++4H2O.
(6)重复三次滴定,结果记录如下表:计算该工业废水中亚铁离子的浓度为0.2mol/L
| 实验序号 | 高锰酸钾溶液体积(ml) | 废水样品的体积(ml) |
| 1 | 10.02 | 25.00 |
| 2 | 10.62 | 25.00 |
| 3 | 9.98 | 25.00 |
14.下列反应的离子方程式书写正确的是( )
| A. | 醋酸和碳酸钙反应:2H++CO32-═H2O+CO2↑ | |
| B. | 锌片插入硝酸根溶液中:Zn+Ag+═Zn2++Ag | |
| C. | 铜和稀硝酸反应:Cu+2NO3-+4H+═Cu2++2NO2↑+2H2O | |
| D. | 氯气和氢氧化钠溶液反应:Cl2+2OH-═Cl-+ClO-+H2O |
1.工业上用氢气和氮气合成氨的反应是放热反应,在氨的实际合成生产时温度常控制在700K左右,原因是( )
| A. | 高温有利于提高反应的转化率 | |
| B. | 高温可增大反应的限度 | |
| C. | 700K时反应催化剂活性最强,反应速率更快 | |
| D. | 高温才可以自发向右进行 |
11.根据相应的图象,判断下列相关说法正确的是( )


| A. | 密闭容器中反应达到平衡,t0时改变某一条件有如图变化所示,则改变的条件只能是加入催化剂 | |
| B. | 反应达到平衡时外界条件对平衡影响关系如图B所示,则正反应为放热反应,且a>b | |
| C. | 物质的量和温度关系如图C所示,则该反应的正反应为放热反应 | |
| D. | 反应速率和反应条件变化关系如图D所示,则该反应的正反应为放热反应,且A、B、C、D均为气体 |
15.二甲醚(DME)被誉为“21世纪的清洁燃料”.由合成气制备二甲醚的主要原理如下:
反应Ⅰ:CO(g)+2H2(g)?CH3OH(g)△H1
反应Ⅱ:2CH3OH(g)?CH3OCH3(g)+H2O(g)△H2
反应Ⅲ:2CO(g)+4H2(g)?CH3OCH3(g)+H2O(g)△H3
相关反应在不同温度时的平衡常数及其大小关系如下表所示
回答下列问题:
(1)反应Ⅰ的△S<0(填“>”或“<”);反应Ⅱ的平衡常数表达式为$\frac{[C{H}_{3}OC{H}_{3}][{H}_{2}O]}{[C{H}_{3}OH]}$,反应Ⅲ是放热反应(填“吸热”或“放热”).
(2)在合成过程中,因为有CO(g)+H2O(g)?CO2(g)+H2(g),反应发生,所以能提高CH3OCH3的产率,原因是此反应消耗了H2O(g)有利于反应II、III正向移动;同时此反应生成了H2,有利于反应I、III正向移动.
(3)如图1两条曲线分别表示反应I(按物质的量比:n(CO):n(H2)=1:2)中压强为0.1MPa和5.0MPa下CO转化率随温度的变化关系,计算压强为0.1MPa、温度为200℃时,平衡混合气中甲醇的物质的量分数是25%.

(4)反应Ⅲ逆反应速率与时间的关系如2图所示:
①试判断t2时改变的条件是增大生成物C浓度或升高温度.
②若t4扩大容器体积,t5达到平衡,t6时增大反应物浓度,请在图2中画出t4-t6的变化曲线.
反应Ⅰ:CO(g)+2H2(g)?CH3OH(g)△H1
反应Ⅱ:2CH3OH(g)?CH3OCH3(g)+H2O(g)△H2
反应Ⅲ:2CO(g)+4H2(g)?CH3OCH3(g)+H2O(g)△H3
相关反应在不同温度时的平衡常数及其大小关系如下表所示
| 温度/K | 反应I | 反应II | 已知: K1>K2>K1′>K2′ |
| 298 | K1 | K2 | |
| 328 | K1′ | K2′ |
(1)反应Ⅰ的△S<0(填“>”或“<”);反应Ⅱ的平衡常数表达式为$\frac{[C{H}_{3}OC{H}_{3}][{H}_{2}O]}{[C{H}_{3}OH]}$,反应Ⅲ是放热反应(填“吸热”或“放热”).
(2)在合成过程中,因为有CO(g)+H2O(g)?CO2(g)+H2(g),反应发生,所以能提高CH3OCH3的产率,原因是此反应消耗了H2O(g)有利于反应II、III正向移动;同时此反应生成了H2,有利于反应I、III正向移动.
(3)如图1两条曲线分别表示反应I(按物质的量比:n(CO):n(H2)=1:2)中压强为0.1MPa和5.0MPa下CO转化率随温度的变化关系,计算压强为0.1MPa、温度为200℃时,平衡混合气中甲醇的物质的量分数是25%.

(4)反应Ⅲ逆反应速率与时间的关系如2图所示:
①试判断t2时改变的条件是增大生成物C浓度或升高温度.
②若t4扩大容器体积,t5达到平衡,t6时增大反应物浓度,请在图2中画出t4-t6的变化曲线.