题目内容
5.下列有关电解质溶液中微粒的物质的量浓度关系正确的是( )| A. | pH相同的①CH3COONa②NaHCO3③NaAlO2三份溶液中的c(Na+):②>③>① | |
| B. | 将0.5 mol/L的Na2CO3溶液与amol/L的NaHCO3溶液等体积混合,c(Na+)<c(CO32-)+c(HCO3-)+c(H2CO3) | |
| C. | 10mL0.1mol/LCH3COOH溶液与20mL0.1mol/LNaOH溶液混合后,溶液中离子浓度关系:c(OH-)=c(H+)+c(CH3COO-)+2c(CH3COOH) | |
| D. | 25℃某浓度的NaCN溶液的pH=d,则其中由水电离出的c(OH-)=10-dmol/L |
分析 A.pH相同的这几种钠盐,弱酸根离子水解程度越大该钠盐浓度越小,弱酸根离子水解程度与其相对应酸的电离平衡常数成反比;
B.任何电解质溶液中都存在Na、C原子之间的物料守恒,根据物料守恒判断;
C.n(CH3COOH)=0.1mol/L×0.01L=0.001mol,n(NaOH)=0.1mol/L×0.02L=0.002mol,醋酸和NaOH以1:1反应,所以二者混合后溶液中溶质为等物质的量浓度的NaOH、CH3COONa,任何电解质溶液中都存在电荷守恒和物料守恒,根据电荷守恒和物料守恒判断;
D.酸或碱抑制水电离,含有弱离子的盐促进水电离,任何溶液中由水电离出的c(OH-)=c(H+),但因为氢离子或氢氧根离子结合弱离子而导致含有弱离子的盐溶液中c(OH-)、c(H+)不等,该溶液中由水电离出的c(OH-)=$\frac{{K}_{w}}{c({H}^{+})}$.
解答 解:A.pH相同的这几种钠盐,弱酸根离子水解程度越大该钠盐浓度越小,弱酸根离子水解程度与其相对应酸的电离平衡常数成反比,酸的电离程度CH3COOH>H2CO3>Al(OH)3,酸根离子水解程度AlO2->HCO3->CH3COO-,所以pH相同的①CH3COONa②NaHCO3③NaAlO2三份溶液中的c(Na+):①>②>③,故A错误;
B.任何电解质溶液中都存在Na、C原子之间的物料守恒,Na2CO3溶液中存在c(Na+)=2[c(CO32-)+c(HCO3-)+c(H2CO3)],NaHCO3溶液中存在c(CO32-)+c(HCO3-)+c(H2CO3),所以混合溶液中存在c(Na+)>c(CO32-)+c(HCO3-)+c(H2CO3),故B错误;
C.n(CH3COOH)=0.1mol/L×0.01L=0.001mol,n(NaOH)=0.1mol/L×0.02L=0.002mol,醋酸和NaOH以1:1反应,所以二者混合后溶液中溶质为等物质的量浓度的NaOH、CH3COONa,任何电解质溶液中都存在电荷守恒和物料守恒,
根据物料守恒有:2[c(CH3COO-)+c(CH3COOH)]=c(Na+),
根据电荷守恒有:c(Na+)+c(H+)=c(OH-)+c(CH3COO-),
整理得:c(OH-)=c(H+)+c(CH3COO-)+2c(CH3COOH),
故C正确;
D.酸或碱抑制水电离,含有弱离子的盐促进水电离,任何溶液中由水电离出的c(OH-)=c(H+),但因为氢离子或氢氧根离子结合弱离子而导致含有弱离子的盐溶液中c(OH-)、c(H+)不等,该溶液中由水电离出的c(OH-)=$\frac{{K}_{w}}{c({H}^{+})}$=$\frac{1{0}^{-14}}{1{0}^{-d}}$mol/L=10d-14mol/L,故D错误;
故选C.
点评 本题考查离子浓度大小比较,为高频考点,涉及盐类水解、弱电解质的电离、酸碱混合溶液定性判断等知识点,明确溶液中溶质及其性质是解本题关键,注意电荷守恒和物料守恒的灵活运用,易错选项是BD,注意:电荷守恒和物料守恒与溶液中溶质多少无关、与溶液酸碱性无关,题目难度不大.

| A. |  固体的溶解 | B. |  流体的倾倒 | ||
| C. |  移走加热的蒸发皿 | D. |  读数 |
| A. | 用乙烷和氯气等物质的量混合可以得到纯净的氯乙烷 | |
| B. | 将稀硫酸和无水酒精按3:1的体积比混合加热到170℃制取乙烯 | |
| C. | 将电石和饱和食盐水置于启普发生器中制取乙炔 | |
| D. | 用酸性KMnO4溶液可将己烷和己烯二种无色液体鉴别开来 |
| A. | 铜片接电源的正极 | |
| B. | 铜片上发生的反应是:Ag++e-═Ag | |
| C. | 银片上发生的反应是:4OH--4e-═O2↑+2H2O | |
| D. | 需用硫酸铜溶液为电镀液 |
(1)煤的气化是煤在高温下转化为水煤气的过程,主要反应方程式是C+H2O(g)$\frac{\underline{\;高温\;}}{\;}$CO+H2.
(2)煤的液化发生的主要反应如下表:
| 化学反应方程式 | 平衡常数 | |
| 500℃ | 700℃ | |
| ①2H2(g)+CO(g)=CH3OH(g)△H1=akJ/mol | 2.5 | 0.2 |
| ②H2(g)+CO2(g)=CO(g)+H2O(g)△H2=bkJ/mol | 1.0 | 2.3 |
| ③3H2(g)+CO2(g)=CH3OH(g)+H2O(g)△H3 | K3 | 4.6 |
②若反应①在容积为2L的密闭容器中进行,500℃测得某一时刻体系内H2、CO、CH30H物质的量分别为4、2、10,则此时生成CH30H的速率>消耗CH30H的速率(填“>”、“<”、“=”)
③K3=2.5.
(3)烯烃化阶段:图1是烯烃化阶段产物中乙烯、丙烯的选择性与温度、压强之间的关系(选择性:指生成某物质的百分比.图中I、II表示乙烯,III表示丙烯).
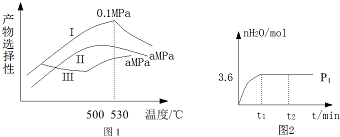
①根据图1,要尽可能多的获得乙烯,控制反应的最佳条件是530℃,0.1Mpa.
②一定温度下,某密闭容器发生如下反应:2CH3OH(g)=CH2=CH2(g)+2H2O(g),在压强为P1时,产物水的物质的量与时间的关系如图2所示,若t1时测得甲醇的体积分数是10%,此时甲醇乙烯化的转化率是85.7%(保留3位有效数字),若要提高甲醇的转化率,可采取的措施是降低压强、分离乙烯或水(写一条即可).
③若在t2时,将容器体积迅速扩大到原来的2倍,请图2中绘制出此变化发生后至反应达到新平衡时水的物质的量与时间的关系.
| A. | 液态HCl、固态NaCl均不导电,所以HCl、NaCl均不是电解质 | |
| B. | 蔗糖、酒精在水溶液或熔化时均不导电,所以它们是非电解质 | |
| C. | 铜、石墨均导电,所以它们是电解质 | |
| D. | NH3、CO2的水溶液均导电,所以NH3、CO2均是电解质 |
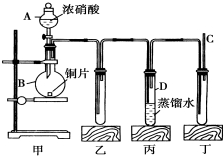 某学校化学学习小组为探究二氧化氮的性质,按如图所示装置进行实验.
某学校化学学习小组为探究二氧化氮的性质,按如图所示装置进行实验.