题目内容
二甲氧基甲烷[CH2(OCH3)2]水溶性好、含氧量高、燃烧完全、烟气排放量低,被认为是一种极具应用前景的柴油添加剂.工业生产CH2(OCH3)2一般是在催化剂作用下,将37%的甲醛水溶液和甲醇混合共热,反应原理如下:HClO+2CH3OH
CH2(OCH3)2+H2O
(1)某次研究反应时间对产率的影响的实验中,CH2(OCH3)2的浓度随反应时间变化如下表:
计算25~50min中CH2(OCH3)2的平均生成速率为 .
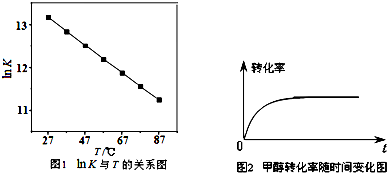
(2)研究反应的化学平衡常数(记作lnK)与温度(T)的关系如图1所示,判断该反应的△H 0(填“>”、“<”、“=”).
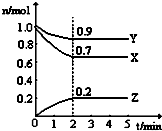
(3)假设在密闭容器中发生上述反应,①达到平衡时下列措施能提高HCHO 转化率的是 .
A.及时从反应体系中分离出CH2(OCH3)2 B.升高反应体系的温度
C.再添加适量甲醇 D.增大压强
②图2是催化剂作用下CH3OH 转化率随时间变化的趋势曲线图.请在图2中画出相同条件下,不使用催化剂时CH3OH转化率随时间变化的曲线.
(4)进一步研究发现:甲醛的滴加速率、反应时间、催化剂的量和搅拌速率等对CH2(OCH3)2的工业实际产率(不完全是平衡状态下得出的)也会产生一定影响.欲分别研究甲醛的滴加速率、搅拌速率对产率的影响,某同学设计了三组实验如下表:
①请在上表空格中填入剩余的实验条件数据.
②在研究过程中发现,甲醛的滴加速率过慢或过快均会使CH2(OCH3)2产率降低.请结合该反应的合成机理:
HCHO
HOCH2OCH3
CH2(OCH3)2
试分析甲醛的滴加速率过快时,导致产率较低的原因可能是 .
| 催化剂 |
| △ |
(1)某次研究反应时间对产率的影响的实验中,CH2(OCH3)2的浓度随反应时间变化如下表:
| 时间(min) | 20 | 25 | 30 | 40 | 50 | 60 |
| CH2(OCH3)2(mol/L) | 9.02 | 9.10 | 9.18 | 9.23 | 9.30 | 9.32 |
(2)研究反应的化学平衡常数(记作lnK)与温度(T)的关系如图1所示,判断该反应的△H

(3)假设在密闭容器中发生上述反应,①达到平衡时下列措施能提高HCHO 转化率的是
A.及时从反应体系中分离出CH2(OCH3)2 B.升高反应体系的温度
C.再添加适量甲醇 D.增大压强
②图2是催化剂作用下CH3OH 转化率随时间变化的趋势曲线图.请在图2中画出相同条件下,不使用催化剂时CH3OH转化率随时间变化的曲线.
(4)进一步研究发现:甲醛的滴加速率、反应时间、催化剂的量和搅拌速率等对CH2(OCH3)2的工业实际产率(不完全是平衡状态下得出的)也会产生一定影响.欲分别研究甲醛的滴加速率、搅拌速率对产率的影响,某同学设计了三组实验如下表:
| 影响因素 试验号 |
甲醛的滴加速率(g/min) | 反应时间(min) | 催化剂的量(g) | 搅拌速率 |
| 1 | 70 | 2.5 | 30 | |
| 2 | 1.0 | |||
| 3 | 2.5 | 80 |
②在研究过程中发现,甲醛的滴加速率过慢或过快均会使CH2(OCH3)2产率降低.请结合该反应的合成机理:
HCHO
| CH3OH |
| H+ |
| CH3OH |
| -H2O |
试分析甲醛的滴加速率过快时,导致产率较低的原因可能是
考点:化学平衡常数的含义,反应速率的定量表示方法,化学平衡的影响因素,转化率随温度、压强的变化曲线
专题:化学平衡专题
分析:(1)25~50min中CH2(OCH3)2的浓度的变化计算化学反应速率;
(2)随温度升高,K减小,则正反应方向放热;
(3)①使化学平衡向右移动,可提高HCHO 转化率;
②催化剂只加快反应速率,不影响化学平衡移动;
(4)①其他条件相同时才能比较甲醛的滴加速率、搅拌速率对产率的影响;
②甲醛滴加过快会使合成反应主要停留在中间产物HOCH2OCH3;实验用的是37%的甲醛溶液,不利用脱水,不利用平衡向正反应方向移动,故产率降低.
(2)随温度升高,K减小,则正反应方向放热;
(3)①使化学平衡向右移动,可提高HCHO 转化率;
②催化剂只加快反应速率,不影响化学平衡移动;
(4)①其他条件相同时才能比较甲醛的滴加速率、搅拌速率对产率的影响;
②甲醛滴加过快会使合成反应主要停留在中间产物HOCH2OCH3;实验用的是37%的甲醛溶液,不利用脱水,不利用平衡向正反应方向移动,故产率降低.
解答:
解:(1)25~50min中CH2(OCH3)2的浓度的变化为:(9.30-9.10)mol/L=0.20mol/L,化学反应速率为:v=
=
=0.008 mol/(L?min),
故答案为:0.008 mol/(L?min);
(2)随温度升高,K减小,则正反应方向放热,故△H<0,故答案为:<;
(3)①使化学平衡向右移动,可提高HCHO 转化率,
A.减小生成物浓度,化学平衡向右移动,故A正确;
B.反应放热,升高温度向逆反应方向移动,故B错误;
C.增大甲醇浓度,化学平衡向右移动,故C正确;
D.增大压强,化学平衡向逆反应方向移动,故D错误;
故选:AC;
②催化剂只加快反应速率,不影响化学平衡移动,故答案为: ;
;
(4)①其他条件相同时才能比较甲醛的滴加速率、搅拌速率对产率的影响,即反应时间和催化剂的量相同,反应2为比较的标准,所以反应1和反应3的甲醛滴加速率不同,反应1与反应2相同;反应1和反应3的搅拌速率不同,反应3与反应2搅拌速率不同,故答案为:
;
②甲醛滴加过快会使合成反应主要停留在中间产物HOCH2OCH3;实验用的是37%的甲醛溶液,不利用脱水,不利用平衡向正反应方向移动,故产率降低,
故答案为:甲醛滴加过快会使合成反应主要停留在中间产物HOCH2OCH3或实验用的是37%的甲醛溶液,不利用脱水,不利用平衡向正反应方向移动,故产率降低.
| △c |
| △t |
| 0.20mol/L |
| 50min-25min |
故答案为:0.008 mol/(L?min);
(2)随温度升高,K减小,则正反应方向放热,故△H<0,故答案为:<;
(3)①使化学平衡向右移动,可提高HCHO 转化率,
A.减小生成物浓度,化学平衡向右移动,故A正确;
B.反应放热,升高温度向逆反应方向移动,故B错误;
C.增大甲醇浓度,化学平衡向右移动,故C正确;
D.增大压强,化学平衡向逆反应方向移动,故D错误;
故选:AC;
②催化剂只加快反应速率,不影响化学平衡移动,故答案为:
 ;
;(4)①其他条件相同时才能比较甲醛的滴加速率、搅拌速率对产率的影响,即反应时间和催化剂的量相同,反应2为比较的标准,所以反应1和反应3的甲醛滴加速率不同,反应1与反应2相同;反应1和反应3的搅拌速率不同,反应3与反应2搅拌速率不同,故答案为:
| 1 | 1.0 | |||
| 2 | 70 | 2.5 | 80 | |
| 3 | 70 | 2.5 |
②甲醛滴加过快会使合成反应主要停留在中间产物HOCH2OCH3;实验用的是37%的甲醛溶液,不利用脱水,不利用平衡向正反应方向移动,故产率降低,
故答案为:甲醛滴加过快会使合成反应主要停留在中间产物HOCH2OCH3或实验用的是37%的甲醛溶液,不利用脱水,不利用平衡向正反应方向移动,故产率降低.
点评:本题综合性较大,考查化学平衡常数、平衡移动、电解质溶液有关计算、盐类水解等,难度中等,是对学生综合能力的考查.

练习册系列答案
相关题目
分子式为C8H10O的芳香族化合物,遇三氯化铁溶液不显色,能与金属钠反应放出氢气,满足条件的同分异构体有( )
| A、4种 | B、5种 |
| C、10种 | D、大于10种 |
向等物质的量浓度的NaOH和Na2CO3的混合溶液中加入稀盐酸,下列离子方程式与事实不符的是( )
| A、OH-+CO32-+2H+→HCO3-+H2O |
| B、2OH-+CO32-+3H+→HCO3-+2H2O |
| C、2OH-+CO32-+4H+→CO2↑+3H2O |
| D、OH-+CO32-+3H+→CO2↑+2H2O |
 某温度时,在一个2L的密闭容器中,H2、N2、NH3三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,回答下列问题:
某温度时,在一个2L的密闭容器中,H2、N2、NH3三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,回答下列问题: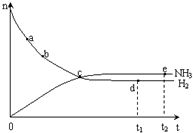 合成氨工业对国民经济和社会发展具有重要的意义. 合成塔中发生反应为:N2(g)+3H2(g)?2NH3(g)△H<0
合成氨工业对国民经济和社会发展具有重要的意义. 合成塔中发生反应为:N2(g)+3H2(g)?2NH3(g)△H<0 (1)已知下列两个热化学方程式:
(1)已知下列两个热化学方程式: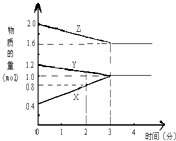 某温度时,在3L密闭容器中,X、Y、Z三种物质的物质的量随时间变化的曲线如图所示.由图中数据分析:
某温度时,在3L密闭容器中,X、Y、Z三种物质的物质的量随时间变化的曲线如图所示.由图中数据分析: