题目内容
向等物质的量浓度的NaOH和Na2CO3的混合溶液中加入稀盐酸,下列离子方程式与事实不符的是( )
| A、OH-+CO32-+2H+→HCO3-+H2O |
| B、2OH-+CO32-+3H+→HCO3-+2H2O |
| C、2OH-+CO32-+4H+→CO2↑+3H2O |
| D、OH-+CO32-+3H+→CO2↑+2H2O |
考点:真题集萃,离子方程式的书写
专题:离子反应专题
分析:等物质的量浓度的NaOH和Na2CO3的混合溶液中含有氢氧化钠与碳酸钠的物质的量相等,稀盐酸加入到NaOH和Na2CO3的混合溶液中,盐酸先与氢氧化钠发生酸碱中和,剩余的盐酸再与碳酸钠发生反应,盐酸少量时发生CO32-+H+→HCO3-,盐酸过量时发生CO32-+2H+→CO2↑+H2O.
解答:
解:根据题意可知,等物质的量浓度的NaOH和Na2CO3的混合溶液中,含有的氢氧化钠与碳酸钠的物质的量相等,稀盐酸加入到NaOH和Na2CO3的混合溶液中,盐酸先与氢氧化钠发生酸碱中和,剩余的盐酸再与碳酸钠发生反应.
A.设NaOH和Na2CO3的物质的量都为1mol,则加入盐酸少量,先发生反应:OH-+H+→H2O,1mol氢氧化钠消耗1mol盐酸,再发生反应CO32-+H+→HCO3-,将两个方程式相加得:OH-+CO32-+2H+→HCO3-+H2O,故A正确;
B.设NaOH和Na2CO3的物质的量都为2mol,则加入盐酸少量,先发生反应:2OH-+2H+→2H2O,2mol氢氧化钠消耗2mol盐酸,再发生反应CO32-+H+→HCO3-,盐酸不足之消耗1mol碳酸钠,将两个方程式相加得:2OH-+CO32-+3H+→HCO3-+2H2O,故B正确;
C.设NaOH和Na2CO3的物质的量都为2mol,2mol氢氧化钠消耗2mol氢离子,剩余2mol氢离子与2mol碳酸钠反应生成2mol碳酸氢根离子,离子方程式应为2OH-+2CO32-+4H+→2HCO3-+2H2O,即OH-+CO32-+2H+→HCO3-+H2O,故C错误;
D.设NaOH和Na2CO3的物质的量都为1mol,则加入盐酸过量,先发生反应:OH-+H+→H2O,1mol氢氧化钠消耗1mol盐酸,再发生反应CO32-+2H+→CO2↑+H2O,将两个方程式相加得:OH-+CO32-+3H+→CO2↑+2H2O,故D正确;
故选:C.
A.设NaOH和Na2CO3的物质的量都为1mol,则加入盐酸少量,先发生反应:OH-+H+→H2O,1mol氢氧化钠消耗1mol盐酸,再发生反应CO32-+H+→HCO3-,将两个方程式相加得:OH-+CO32-+2H+→HCO3-+H2O,故A正确;
B.设NaOH和Na2CO3的物质的量都为2mol,则加入盐酸少量,先发生反应:2OH-+2H+→2H2O,2mol氢氧化钠消耗2mol盐酸,再发生反应CO32-+H+→HCO3-,盐酸不足之消耗1mol碳酸钠,将两个方程式相加得:2OH-+CO32-+3H+→HCO3-+2H2O,故B正确;
C.设NaOH和Na2CO3的物质的量都为2mol,2mol氢氧化钠消耗2mol氢离子,剩余2mol氢离子与2mol碳酸钠反应生成2mol碳酸氢根离子,离子方程式应为2OH-+2CO32-+4H+→2HCO3-+2H2O,即OH-+CO32-+2H+→HCO3-+H2O,故C错误;
D.设NaOH和Na2CO3的物质的量都为1mol,则加入盐酸过量,先发生反应:OH-+H+→H2O,1mol氢氧化钠消耗1mol盐酸,再发生反应CO32-+2H+→CO2↑+H2O,将两个方程式相加得:OH-+CO32-+3H+→CO2↑+2H2O,故D正确;
故选:C.
点评:本题考查了离子方程式书写正误的判断,题目难度中等,明确稀盐酸与NaOH和Na2CO3反应的先后顺序以及碳酸钠与盐酸反应的原理是解题的关键.

练习册系列答案
 天天练口算系列答案
天天练口算系列答案
相关题目
下列反应属于氧化还原反应的是( )
A、CaCO3
| ||||
B、CuO+CO
| ||||
| C、NaOH+HCl═H2O+NaCl | ||||
| D、CuSO4+2NaOH═Cu(OH)2↓+Na2SO4 |
芳香烃分子式C9H12,同分异构体有( )种,其中苯环上的一溴代物只有两种的同分异构体有( )种.
| A、8种;2种 |
| B、8种;3种 |
| C、7种;3种 |
| D、7种;2种 |
下列气体能用排水法收集的是( )
| A、NO2 |
| B、SO2 |
| C、O2 |
| D、NH3 |
下列叙述中,错误的是( )
| A、分子中中心原子通过sp3杂化轨道成键时,该分子不一定为正四面体结构 |
| B、sp3、sp2、sp杂化轨道的夹角分别为109°28′、120°、180° |
| C、分子间氢键会使物质的熔点沸点升高,而分子内氢键对熔沸点影响不大 |
| D、杂化轨道可用于形成σ键、π键或用于容纳未参与成键的孤电子对 |
下列关于有机物的说法中正确的( )
A、新药帕拉米韦对禽流感H7N9有显著疗效,它的结构简式为 化学式是C15H26N4O4 化学式是C15H26N4O4 |
| B、2013年11月20日山东现‘夺命快递’----化学品泄漏致1死7中毒.该化学品为氟乙酸甲酯它是无色透明液体,溶于乙醇、乙醚,不溶于水.它属于酯类,也属于卤代烃 |
C、绿原酸的结构简式为: ,它在一定条件下能发生氧化、加成、酯化、水解、消去、加聚、缩聚反应 ,它在一定条件下能发生氧化、加成、酯化、水解、消去、加聚、缩聚反应 |
D、苯的同系物  ,其所有碳原子不可能在同一平面上 ,其所有碳原子不可能在同一平面上 |
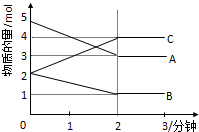 某可逆反应从0-2分钟进行过程中,在不同反应时间各物质的量的变化情况如图所示:
某可逆反应从0-2分钟进行过程中,在不同反应时间各物质的量的变化情况如图所示:
 如图所示的两个实验装置中,均为500mL氯化铜溶液,试回答下列问题:
如图所示的两个实验装置中,均为500mL氯化铜溶液,试回答下列问题: