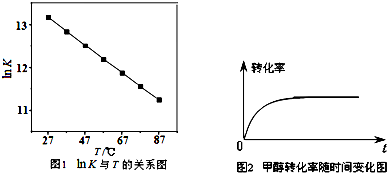
题目内容
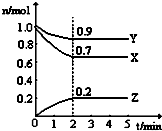 某温度时,在一个2L的密闭容器中,H2、N2、NH3三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,回答下列问题:
某温度时,在一个2L的密闭容器中,H2、N2、NH3三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,回答下列问题:(1)图中X曲线代表
(2)从开始至2min,NH3的平均反应速率是
(3)第4分钟时下列叙述正确的是
A.该反应已停止
B.单位时间内氮气的消耗速率等于氢气的生成速率
C. 3v(H2)=2v(NH3)
D.c(H2):c(N2):c(NH3)=7:9:2
(4)若拆开1mol H-H键,1mol N-H键,1mol N≡N键分别需要吸收的能量为436kJ,391kJ,946kJ.
则1mol N2与3mol H2反应完全转化为NH3应
考点:物质的量或浓度随时间的变化曲线
专题:化学平衡专题
分析:(1)根据图中各物质的变化的物质的量结合化学方程式中的计量数作推断;
(2)根据v=
计算反应速率;
(3)根据可逆反应及平衡状态的特征结合图中的数据作判断;
(4)根据反应物键能减去生成物键能可计算出反应热,并判断反应是否放热;
(2)根据v=
| △c |
| △t |
(3)根据可逆反应及平衡状态的特征结合图中的数据作判断;
(4)根据反应物键能减去生成物键能可计算出反应热,并判断反应是否放热;
解答:
解:(1)根据图中各物质的变化的物质的量可知,△n(X):△n(Y):△n(Z)=(1.0mol-0.7mol):(1.0mol-0.9mol):0.2mol=3::2,对照化学方程式N2(g)+3H2(g)?2NH3(g)可知,X线表示H2,故答案为:H2;
(2)因为Z线表示NH3,结合图中数据NH3的平均反应速率为
=
=0.05mol/(L?min),故答案为:0.05mol/(L?min);
(3)A、第4分钟时反应处于平衡状态,正逆反应速率相等,但不等于零,故A错误;
B、由于反应中氢气的计量数与氮气的计量数不相等,所以反应处于平衡状态时,单位时间内氮气的消耗速率不等于氢气的生成速率,故B错误;
C、由于反应中氢气的计量数与氨气的计量数之比为3:2,所以有2v(H2)=3v(NH3),C错误;
D、由于体系在同一容器中,所以有浓度之比等于物质的量之比再由图象可知,n(H2):n(N2):n(NH3)=7:9:2,则c(H2):c(N2):c(NH3)=7:9:2,故D正确;
故答案为:D;
(4)在反应N2(g)+3H2(g)?2NH3(g)中,根据反应物键能减去生成物键能可得反应热为:△H=(946kJ+3×436kJ-6×391kJ)/mol=-92kJ/mol,故该反应为放热反应,放出热量为92KJ,故答案为:放热;92KJ;
(2)因为Z线表示NH3,结合图中数据NH3的平均反应速率为
| △c |
| △t |
| ||
| 2min |
(3)A、第4分钟时反应处于平衡状态,正逆反应速率相等,但不等于零,故A错误;
B、由于反应中氢气的计量数与氮气的计量数不相等,所以反应处于平衡状态时,单位时间内氮气的消耗速率不等于氢气的生成速率,故B错误;
C、由于反应中氢气的计量数与氨气的计量数之比为3:2,所以有2v(H2)=3v(NH3),C错误;
D、由于体系在同一容器中,所以有浓度之比等于物质的量之比再由图象可知,n(H2):n(N2):n(NH3)=7:9:2,则c(H2):c(N2):c(NH3)=7:9:2,故D正确;
故答案为:D;
(4)在反应N2(g)+3H2(g)?2NH3(g)中,根据反应物键能减去生成物键能可得反应热为:△H=(946kJ+3×436kJ-6×391kJ)/mol=-92kJ/mol,故该反应为放热反应,放出热量为92KJ,故答案为:放热;92KJ;
点评:本题考查了反应速率的计算,平衡状态的特征及反应热的计算,有一定的综合性,但内容较简单,注重对基础知识的理解.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
分离下列物质时可用重结晶法的是( )
| A、蔗糖中含有泥沙 |
| B、汽油中含有水 |
| C、氯化钠和硝酸钾混合物 |
| D、硫粉和铁粉 |
下列气体能用排水法收集的是( )
| A、NO2 |
| B、SO2 |
| C、O2 |
| D、NH3 |
下列关于有机物的说法中正确的( )
A、新药帕拉米韦对禽流感H7N9有显著疗效,它的结构简式为 化学式是C15H26N4O4 化学式是C15H26N4O4 |
| B、2013年11月20日山东现‘夺命快递’----化学品泄漏致1死7中毒.该化学品为氟乙酸甲酯它是无色透明液体,溶于乙醇、乙醚,不溶于水.它属于酯类,也属于卤代烃 |
C、绿原酸的结构简式为: ,它在一定条件下能发生氧化、加成、酯化、水解、消去、加聚、缩聚反应 ,它在一定条件下能发生氧化、加成、酯化、水解、消去、加聚、缩聚反应 |
D、苯的同系物  ,其所有碳原子不可能在同一平面上 ,其所有碳原子不可能在同一平面上 |
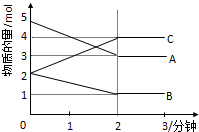 某可逆反应从0-2分钟进行过程中,在不同反应时间各物质的量的变化情况如图所示:
某可逆反应从0-2分钟进行过程中,在不同反应时间各物质的量的变化情况如图所示: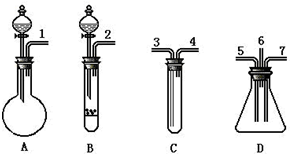 根据下面提供的仪器和试剂,完成验证SO2既有氧化性又有还原性的实验.可选用的仪器如图所示:
根据下面提供的仪器和试剂,完成验证SO2既有氧化性又有还原性的实验.可选用的仪器如图所示: