题目内容
甲、乙、丙、丁四种元素的原子序数如表中所示:
(1)填写下表:
(2)写出这几种元素的单质间反应的化学方程式:
甲与乙:
乙与丙:
乙与丁: .
(1)填写下表:
| 元素 | 甲 | 乙 | 丙 | 丁 |
| 原子序数 | 6 | 8 | 11 | 13 |
| 元素符号 | ||||
| 周期 | ||||
| 族 |
甲与乙:
乙与丙:
乙与丁:
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:(1)6号元素甲是C,8号元素乙是O,11号元素丙为Na,13号元素丁为Al,周期数=电子层数、主族族序数=最外层电子数,据此确定在周期表中的位置;
(2)碳与足量的氧气反应生成二氧化碳;Na与氧气在常温下反应生成氧化钠、在加热条件下反应生成过氧化钠;Al与氧气反应生成氧化铝.
(2)碳与足量的氧气反应生成二氧化碳;Na与氧气在常温下反应生成氧化钠、在加热条件下反应生成过氧化钠;Al与氧气反应生成氧化铝.
解答:
解:(1)6号元素甲是C,原子核外有2个电子层、最外层电子数为4,处于第二周期IVA族;
8号元素乙是O,原子核外有2个电子层、最外层电子数为6,处于第二周期VIA族;
11号元素丙为Na,原子核外有3个电子层、最外层电子数为1,处于第三周期IA族;
13号元素丁为Al,原子核外有3个电子层、最外层电子数为3,处于第三周期ⅢA族,
故答案为:
;
(2)碳在足量氧气中燃烧生成二氧化碳,反应方程式为:C+O2
CO2;
钠与氧气在常温下反应生成氧化钠、在加热条件下反应生成过氧化钠,反应方程式为:4Na+O2=2Na2O或2Na+O2
2Na2O2;
氧气与铝反应生成氧化铝,反应方程式为:4Al+3O2
2Al2O3,
故答案为:C+O2
CO2;4Na+O2=2Na2O或2Na+O2
2Na2O2;4Al+3O2
2Al2O3.
8号元素乙是O,原子核外有2个电子层、最外层电子数为6,处于第二周期VIA族;
11号元素丙为Na,原子核外有3个电子层、最外层电子数为1,处于第三周期IA族;
13号元素丁为Al,原子核外有3个电子层、最外层电子数为3,处于第三周期ⅢA族,
故答案为:
| 元素 | 甲 | 乙 | 丙 | 丁 |
| 原子序数 | 6 | 8 | 11 | 13 |
| 元素符号 | C | O | Na | Al |
| 周期 | 2 | 2 | 3 | 3 |
| 族 | IVA | VIA | IA | ⅢA |
(2)碳在足量氧气中燃烧生成二氧化碳,反应方程式为:C+O2
| ||
钠与氧气在常温下反应生成氧化钠、在加热条件下反应生成过氧化钠,反应方程式为:4Na+O2=2Na2O或2Na+O2
| ||
氧气与铝反应生成氧化铝,反应方程式为:4Al+3O2
| ||
故答案为:C+O2
| ||
| ||
| ||
点评:本题考查结构与位置关系、元素单质化合物性质,比较基础,注意对基础知识的全面掌握.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
常温下,下列各组物质中,Y既能与X反应又能与Z反应的是( )
| X | Y | Z | |
| ① | NaOH溶液 | Al(OH)3 | 稀硫酸 |
| ② | KOH溶液 | SiO2 | 浓盐酸 |
| ③ | O2 | N2 | H2 |
| ④ | FeCl3溶液 | Cu | 浓硝酸 |
| A、①③ | B、①④ | C、②④ | D、②③ |
下列关于物质分类的说法正确的是( )
| A、金刚石、白磷都属于单质 |
| B、漂白粉、石英都属于纯净物 |
| C、氯化铵、次氯酸都属于强电解质 |
| D、葡萄糖、蛋白质都属于高分子化合物 |

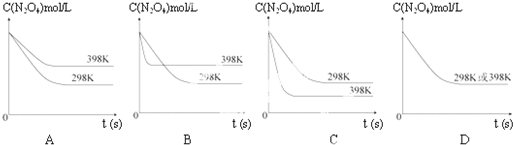
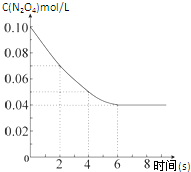 在温度为298K时,将0.10mol无色的N2O4气体放入1L抽空的密闭容器中,出现红棕色,直至建立N2O4(g)?2NO2(g)的平衡.下图表示测定N2O4的浓度与时间关系的曲线(纵坐标为N2O4的浓度,横坐标为时间).
在温度为298K时,将0.10mol无色的N2O4气体放入1L抽空的密闭容器中,出现红棕色,直至建立N2O4(g)?2NO2(g)的平衡.下图表示测定N2O4的浓度与时间关系的曲线(纵坐标为N2O4的浓度,横坐标为时间).