题目内容
下列除杂方案错误的是( )
| 选项 | 被提纯的物质 | 杂质 | 除杂试剂 | 除杂方法 |
| A | CO(g) | CO2(g) | NaOH溶液,浓H2SO4 | 洗气 |
| B | NH4Cl(aq) | Fe3+(aq) | NaOH溶液 | 过滤 |
| C | Cl2(g) | HCl(g) | 饱和食盐水,浓H2SO4 | 洗气 |
| D | Na2CO3(s) | NaHCO3(s) | -- | 灼烧 |
| A、A | B、B | C、C | D、D |
考点:物质的分离、提纯的基本方法选择与应用
专题:实验评价题
分析:A.二氧化碳与NaOH反应,而CO不能;
B.NaOH与NH4Cl、Fe3+均反应;
C.HCl极易溶液水,而食盐水抑制氯气的溶解;
D.NaHCO3加热分解生成碳酸钠.
B.NaOH与NH4Cl、Fe3+均反应;
C.HCl极易溶液水,而食盐水抑制氯气的溶解;
D.NaHCO3加热分解生成碳酸钠.
解答:
解:A.二氧化碳与NaOH反应,而CO不能,则洗气后利用浓硫酸干燥即可除杂,故A正确;
B.NaOH与NH4Cl、Fe3+均反应,将原物质反应掉,不符合除杂的原则,故B错误;
C.HCl极易溶液水,而食盐水抑制氯气的溶解,则洗气后利用浓硫酸干燥即可除杂,故C正确;
D.NaHCO3加热分解生成碳酸钠,则直接加热即可实现除杂,故D正确;
故选B.
B.NaOH与NH4Cl、Fe3+均反应,将原物质反应掉,不符合除杂的原则,故B错误;
C.HCl极易溶液水,而食盐水抑制氯气的溶解,则洗气后利用浓硫酸干燥即可除杂,故C正确;
D.NaHCO3加热分解生成碳酸钠,则直接加热即可实现除杂,故D正确;
故选B.
点评:本题考查物质分离提纯的方法及选择,为高频考点,把握物质的性质及常见的混合物分离方法为解答的关键,注意除杂的原则,题目难度不大.

练习册系列答案
 同步练习强化拓展系列答案
同步练习强化拓展系列答案
相关题目
下列性质比较中,正确的是( )
| A、热稳定性:CH4>SiH4 |
| B、酸性:H2SO4>HClO4 |
| C、熔点、沸点:O2>S |
| D、原子半径:N>P |
下列关于物质分类的说法正确的是( )
| A、金刚石、白磷都属于单质 |
| B、漂白粉、石英都属于纯净物 |
| C、氯化铵、次氯酸都属于强电解质 |
| D、葡萄糖、蛋白质都属于高分子化合物 |
已知某溶液中Cl-、Br-、I-的离子数之比为1:2:3,要使其溶液中的Cl-、Br-、I-的离子数之比变为1:1:1,则通入Cl2的分子数与原溶液中I-离子数之比为( )
| A、1:2 | B、1:3 |
| C、1:6 | D、3:1 |
 一定温度下,向容积为2L的密闭容器中通入两种气体发生化学反应,反应中各物质的物质的量变化如图所示,对该反应的推断合理的是( )
一定温度下,向容积为2L的密闭容器中通入两种气体发生化学反应,反应中各物质的物质的量变化如图所示,对该反应的推断合理的是( )| A、反应进行到6 s时,各物质的反应速率相等 |
| B、反应进行到1 s时,v (A)=v (C) |
| C、反应进行到6 s时,B的平均反应速率为0.1 mol/(L?s) |
| D、该反应的化学方程式为3B+4C?6A+2D |
下表所示的是某些弱酸的电离常数(常温下),下列判断或说法不正确的是( )
| 弱酸 | 电离常数 | 弱酸 | 电离常数 |
| H2CO3 | K1=4.4x 10-7 K2=4.7x 10-11 |
CH3COOH | K=1.75x 10-5 |
| H2SO3 | K1=1.54x 10-2 K2=1.01x 10-7 |
H2C2O4 | K1=5.4x 10-2 K2=5.4x 10-5 |
| A、上述四种酸的酸性强弱顺序为:H2C2O4>H2SO3>CH3COOH>H2CO3 |
| B、物质的量浓度相等的CH3COONa、NaHCO3两溶液中:c(CH3COO-)>c(HCO3-) |
| C、0.1mol/L NaHSO3溶液中的电荷守恒表达式:c(Na+)+c(H+)=c(HSO3-)+2 c(SO32-)+c(OH-) |
| D、0.1mol/L NaHC2O4溶液中c(Na+)、c(HC2O4-)、c(OH-)、c(H+)的大小顺序为:c(Na+)>c(HC2O4-)>c(OH-)>c(H+) |
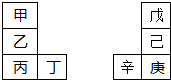 甲~辛等元素在周期表中的相对位置如图.甲与戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质,丁与辛属同周期元素,下列判断正确的是( )
甲~辛等元素在周期表中的相对位置如图.甲与戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质,丁与辛属同周期元素,下列判断正确的是( )| A、金属性:甲>乙>丁 |
| B、原子半径:辛>己>戊 |
| C、丙与庚的原子核外电子数相差13 |
| D、乙的单质在空气中燃烧生成只含离子键的化合物 |
除去乙烷C2H6中混有的少量乙烯C2H4,选择方案合理是( )
| A、溴水、洗气 |
| B、高锰酸钾、洗气 |
| C、氢气、催化剂加成 |
| D、乙烷脱氢 |
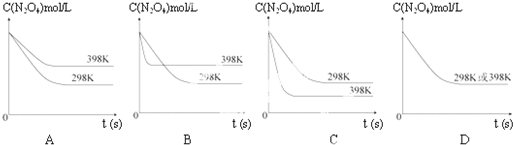
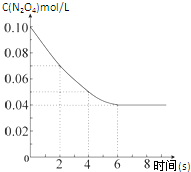 在温度为298K时,将0.10mol无色的N2O4气体放入1L抽空的密闭容器中,出现红棕色,直至建立N2O4(g)?2NO2(g)的平衡.下图表示测定N2O4的浓度与时间关系的曲线(纵坐标为N2O4的浓度,横坐标为时间).
在温度为298K时,将0.10mol无色的N2O4气体放入1L抽空的密闭容器中,出现红棕色,直至建立N2O4(g)?2NO2(g)的平衡.下图表示测定N2O4的浓度与时间关系的曲线(纵坐标为N2O4的浓度,横坐标为时间).