题目内容
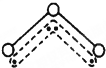 臭氧分子的结构如图,呈V型,三个原子以一个O原子为中心,与另外两个O原子分别构成共价键;中间O原子提供2个电子,旁边两个O原子各提供一个电子,构成一个特殊的化学键:三个O原子均等地享用这4个电子.则下列微粒中与O3的结构最相似的是( )
臭氧分子的结构如图,呈V型,三个原子以一个O原子为中心,与另外两个O原子分别构成共价键;中间O原子提供2个电子,旁边两个O原子各提供一个电子,构成一个特殊的化学键:三个O原子均等地享用这4个电子.则下列微粒中与O3的结构最相似的是( )| A、SO2 |
| B、C3H6 |
| C、CO2 |
| D、CNO- |
考点:判断简单分子或离子的构型
专题:化学键与晶体结构
分析:等电子体结构相似,原子个数相等、价电子数相等的微粒互为等电子体,如果微粒与臭氧分子结构相似,说明该微粒和臭氧属于等电子体,据此分析解答.
解答:
解:臭氧分子中含有3个原子、价电子数是18,
A.二氧化硫分子中含有3个原子、价电子数是18,与臭氧属于等电子体,所以结构相似,故A正确;
B.丙烯分子中原子个数和臭氧分子中原子个数不等,所以不是等电子体,结构不同,故B错误;
C.二氧化碳是直线形分子,且价电子数和臭氧不同,二者结构不同,故C错误;
D.该微粒中价电子数为16,与臭氧分子中价电子数不同,所以不是等电子体,二者结构不同,故D错误;
故选A.
A.二氧化硫分子中含有3个原子、价电子数是18,与臭氧属于等电子体,所以结构相似,故A正确;
B.丙烯分子中原子个数和臭氧分子中原子个数不等,所以不是等电子体,结构不同,故B错误;
C.二氧化碳是直线形分子,且价电子数和臭氧不同,二者结构不同,故C错误;
D.该微粒中价电子数为16,与臭氧分子中价电子数不同,所以不是等电子体,二者结构不同,故D错误;
故选A.
点评:本题考查了判断微粒空间构型及等电子体判断,明确等电子体特征是解本题关键,题目难度不大.

练习册系列答案
相关题目
将 0.2mol的某烷烃完全燃烧后,生成的气体缓缓全部缓慢通过0.5L 2mol/L NaOH溶液中,生成的碳酸钠和碳酸氢钠的物质的量之比为1:3,则该烷烃是( )
| A、CH4 |
| B、C2H6 |
| C、C3H8 |
| D、C4H10 |
下列有关硝酸的说法中正确的是( )
| A、冷的浓硝酸不与铝反应 |
| B、硝酸具有强氧化性和不稳定性 |
| C、硝酸通常略显黄色,是因为在其中溶解了Fe3+的缘故 |
| D、稀硝酸与铁反应生成H2和Fe(NO3)2 |
下列有关实验操作正确或能达到预期目的是( )
A、 测溶液PH |
B、 稀释浓硫酸 |
C、 制取并收集干燥CO2 |
D、 配置100mL 0.1mol?L-1盐酸 |
关于如图所示装置的叙述中正确的是( )
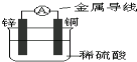

| A、当有0.2mol电子通过电路,产生H2体积为2.24L |
| B、电子从锌片经金属导线流向铜片 |
| C、铜片质量逐渐减少 |
| D、溶液中的氢离子向锌电极移动 |
H2O与H2S结构相似,都是V型的极性分子,但是H2O的沸点是100℃,H2S的沸点是-60.7℃.引起这种差异的主要原因是( )
| A、范德华力 | B、共价键 |
| C、氢键 | D、相对分子质量 |
下列各组物质或微粒中,互为同位素的是( )
A、
| ||||
| B、O2和O3 | ||||
| C、红磷和白磷 | ||||
| D、氯水和液氯 |
实验室中需要配制2mol/L的NaOH溶液950mL,配制 时应选用的容量瓶的规格和称取的NaOH的质量分别是( )
| A、950 mL,78 g |
| B、500 ml,80g |
| C、1 000 mL,80 g |
| D、1 000 mI.,76 g |
下列物质:①BeCl2②SiC③白磷④BF3⑤NH3⑥过氧化氢其中含极性键的非极性分子是( )
| A、①③④ | B、②③⑥ |
| C、①④ | D、①③④⑤ |